Decreto 977
Navegar Norma
Decreto 977
- Encabezado
- TITULO PRELIMINAR
-
TITULO I Principios Generales de Higiene de los Alimentos
- Párrafo I De los establecimientos de alimentos
- Párrafo II Definiciones
- Párrafo III De los requisitos de higiene en la zona de producción/recolección
- Párrafo IV Del proyecto y construcción de los establecimientos
- Párrafo V De los requisitos de higiene de los establecimientos
- Párrafo VI De los requisitos de higiene del personal
- Párrafo VII De los requisitos de higiene en la elaboración de los alimentos
- Párrafo VIII De los requisitos de higiene en el expendio
- Párrafo IX De los requisitos de higiene de los mataderos
- Párrafo X De los requisitos de la inspección de los animales y sus carnes
- Párrafo XI De los requisitos de higiene de las salas de desosado de aves y otras especies distintas del ganado
- Párrafo XII De los requisitos de higiene del transporte y expendio de leches crudas
- TITULO II De los alimentos
- TITULO III De los aditivos alimentarios
- TITULO IV De los Contaminantes y Residuos
- TITULO V De los criterios microbiológicos
- TITULO VI De la irradiación de alimentos
- TITULO VII De la congelación de los alimentos
-
TITULO VIII De las leches y productos lácteos
- Párrafo I Disposiciones generales
- Párrafo II De los requisitos de la leche
- Párrafo II De los requisitos de la leche
- Párrafo III De la pasteurización de la leche
- Párrafo III De la pasteurización de la leche
- Párrafo IV Del envase, conservación y expendio de la leche pasteurizada
- Párrafo V De los productos lácteos
- Párrafo VI De las mantequillas
- Párrafo VII De los quesos
- TITULO IX De los helados y mezclas de helados
- TITULO X De las grasas y aceites comestibles
- TITULO XI De los alimentos cárneos
- TITULO XII De los pescados
- TITULO XIII De los mariscos
- TITULO XIV De los huevos
- TITULO XV De los alimentos farináceos
- TITULO XVI De las levaduras de panificación y de los agentes leudantes
- TITULO XVII De los azúcares y de la miel
- TITULO XVIII De los productos de confitería y similares
- TITULO XIX De las confituras y similares
- TITULO XX De las conservas
- TITULO XXI De los encurtidos
- TITULO XXII De los caldos y sopas deshidratadas
- TITULO XXIII De las especias, condimentos y salsas
- TITULO XXIV De los estimulantes o fruitivos
- TITULO XXV De las comidas y platos preparados
- TITULO XXVI Del agua potable, de las aguas minerales y del hielo
- TITULO XXVII De las bebidas analcohólicas, jugos de frutas y hortalizas y aguas envasadas
-
TITULO XXVIII De los alimentos para regímenes especiales
- Párrafo I Disposiciones generales
- Párrafo II De las fórmulas para lactantes
- Párrafo III De las preparaciones comerciales de alimentos infantiles
- Párrafo IV De los alimentos para uso infantil procesados a base de cereales
- Párrafo V De los alimentos para uso médico o medicinal
- Párrafo VI De los alimentos para regímenes exentos de gluten
- Párrafo VII De los alimentos para regímenes de control de peso
- Párrafo VIII De los alimentos con bajo contenido de grasas y/o calorías
- TITULO XXIX De los suplementos alimentarios y de los alimentos para deportistas
- TITULO XXX De las sanciones
- TITULO FINAL.
- Artículo Transitorio
- Promulgación
Decreto 977 APRUEBA REGLAMENTO SANITARIO DE LOS ALIMENTOS
MINISTERIO DE SALUD
Promulgación: 06-AGO-1996
Publicación: 13-MAY-1997
Versión: Intermedio - de 30-AGO-2016 a 02-OCT-2016
Última modificación: 30-AGO-2016 - Decreto 23
Artículo 470.- Agua mineral de mesa es aquella de composición química especial proveniente de fuentes naturales oficialmente registradas, que es apropiada para servir como bebida de uso común y cuya mineralización es inferior a 1,5 g/l.
Artículo 471.- El agua mineral de mesa deberáDTO 475, SALUD
Art. Unico, N° 128
D.O. 13.01.2000 obtenerse en condiciones que garantice la pureza bacteriológica original y envasarse en su fuente de origen, salvo que su aducción sea hecha desde la captación al punto de envase por medio de tuberías.
Art. Unico, N° 128
D.O. 13.01.2000 obtenerse en condiciones que garantice la pureza bacteriológica original y envasarse en su fuente de origen, salvo que su aducción sea hecha desde la captación al punto de envase por medio de tuberías.
Artículo 472.- El agua mineral natural embotellada deberá cumplir con la normativa sanitaria vigente.DTO 475, SALUD
Art. Unico, N° 129
D.O. 13.01.2000 (Decreto Nº 106 de 1997, del Ministerio de Salud, Reglamento de Aguas Minerales).
Art. Unico, N° 129
D.O. 13.01.2000 (Decreto Nº 106 de 1997, del Ministerio de Salud, Reglamento de Aguas Minerales).
Artículo 473.- El agua mineral no deberáDTO 475, SALUD
Art. Unico, N° 130
D.O. 13.01.2000 contener los contaminantes ni sobrepasar los límites de las sustancias que específicamente determina el Reglamento de Aguas Minerales.
Art. Unico, N° 130
D.O. 13.01.2000 contener los contaminantes ni sobrepasar los límites de las sustancias que específicamente determina el Reglamento de Aguas Minerales.
Artículo 474.- La rotulación del envase de agua mineral, deberá cumplir con los siguientes requisitos adicionales a los establecidos en el Título II:
a) cuando el producto contenga más de 600 mg/l de sulfato que no sea sulfato de calcio, se incluirá en forma destacada la siguiente leyenda " puede ser laxante";
b) cuando el producto contenga más de 1000 mg/l de sólidos totales disueltos o 600 mg/l de HCO3-, se incluirá en forma destacada la siguiente leyenda "puede ser diurético";
c) no se incluirá declaración alguna de propiedades o efectos medicinales.
Artículo 475.- El anhídrido carbónico empleado en la preparación de aguas de bebidas carbonatadas debe contener un mínimo de 98% de este gas y no más de 0,2% de monóxido de carbono y estará exento de sustancias extrañas que le confieran olor y/o sabor desagradable o de cualquiera otra naturaleza.
Artículo 476.- Hielo para consumo humano es el producto obtenido por congelación de agua potable. Sus características químicas y microbiológicas serán las exigidas para el agua potable.
Artículo 477.- Se prohíbe el fraccionamiento del hielo en barras para ser incorporado a los alimentos.
TITULO XXVII
De las bebidas analcohólicas, jugos de frutas yDTO 68, SALUD
Art. primero Nº 30
D.O. 23.01.2006 hortalizas y aguas envasadas
Art. primero Nº 30
D.O. 23.01.2006 hortalizas y aguas envasadas
Artículo 478.- Son bebidas analcohólicas aquellas elaboradas a base de agua potable, carbonatada o no, y adicionadas de una o más de las siguientes sustancias: azúcares, jugos de fruta, extractos vegetales, ácidos, esencias, proteínas, sales minerales, colorantes y otros aditivos permitidos; que no contengan más de 0,5% enDTO 475, SALUD
Art. Unico, N° 131
D.O. 13.01.2000 volumen de alcohol etílico, con excepción de los jarabes, los que podrán contener hasta 2,5 % en volumen de alcohol etílico.
Art. Unico, N° 131
D.O. 13.01.2000 volumen de alcohol etílico, con excepción de los jarabes, los que podrán contener hasta 2,5 % en volumen de alcohol etílico.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 479.- Bebida refrescante de fruta, es aquella bebida analcohólica a la cual se le ha adicionado jugos de frutas o sus extractos y cuyo contenido de sólidos solubles procedentes de frutas es igual o mayor al 10% m/m de los sólidos solubles de la fruta madura que se declara.
Artículo 480.- Bebida de fantasía, es aquella bebida analcohólica que no contiene jugos de frutas o sus extractos, o que ha sido adicionada de éstos pero en cantidad tal que su contenido de sólidos solubles de fruta es menor al 10% m/m.
Artículo 481.- Las bebidas analcohólicas que contengan cafeína o quinina no deberán exceder la cantidad de 180 mg/l de cafeína, ni 130 mg/l de quinina o sus sales expresadas en quinina anhidra.
Artículo 482.- Jugo o zumo puro de fruta u hortaliza es el producto sin fermentar, pero fermentable, pulposo, turbio o claro, destinado al consumo directo, obtenido por procedimientos mecánicos a partir de frutas u hortalizas maduras en buen estado o de sus carnes y conservados exclusivamente por medios físicos. El jugo podrá haber sido concentrado y luego reconstituido con agua para conservar la composición esencial y los factores de calidad del mismo.
Artículo 483.- El jugo o zumo puro de frutas u hortalizas deberá cumplir los siguientes requisitos:
a) el contenido de sólidos solubles, con exclusión de los azúcares añadidos, será igual al contenido de sólidos solubles de la fruta u hortaliza madura de la que provenga;
b) el producto deberá tener el color, aroma y sabor característicos de la fruta u hortaliza de origen. Se permitirá la restitución de los componentes volátiles naturales del jugo cuando hayan sido extraídos, con componentes volátiles exclusivamente naturales;
c) cuando el producto lo requiera podrá añadirse uno o más de los azúcares sólidos definidos en este reglamento, en una cantidad total que no exceda los 50 g/kg, excepto para frutas muy ácidas, en cuyo caso no deberá exceder de 200 g/kg de producto terminado.
Artículo 484.- Jugo o zumo concentrado es el producto sin fermentar pero fermentable una vez reconstituido, conservado exclusivamente por medios físicos y obtenido mediante un proceso de concentración de jugo puro de fruta u hortaliza.
El producto obtenido por la reconstitución del jugo concentrado, mediante la adición de agua en la cantidad indicada por el fabricante, deberá tener las características físico-químicas y organolépticas del jugo de la fruta u hortaliza de origen.
Se permitirá el uso de coadyuvantes de elaboración, antioxidantes, antiespumantes y acidulantes establecidos en el presente reglamento.
Artículo 485.- Néctar de fruta es el producto pulposo o no pulposo, sin fermentar pero fermentable,DTO 68, SALUD
Art. primero Nº 31
D.O. 23.01.2006 obtenido mezclando el jugo o zumo de fruta y/o toda la parte comestible de frutas maduras y sanas concentrado o sin concentrar, con adición de agua y azúcares o miel, y aditivos autorizados.DTO 475, SALUD
Art. Unico, N° 132
D.O. 13.01.2000
Art. primero Nº 31
D.O. 23.01.2006 obtenido mezclando el jugo o zumo de fruta y/o toda la parte comestible de frutas maduras y sanas concentrado o sin concentrar, con adición de agua y azúcares o miel, y aditivos autorizados.DTO 475, SALUD
Art. Unico, N° 132
D.O. 13.01.2000
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 486.- El néctar de frutas deberá cumplir los siguientes requisitos:
a) el contenido de sólidos solubles de los néctares, con
exclusión de azúcares añadidos, será mayor o igual al 20% m/m
de los sólidos solubles de la fruta madura de la que
provenga;
b) podrán adicionarse uno o más azúcares sólidosDTO 475, SALUD
Art. Unico, N° 133
D.O. 13.01.2000
Art. Unico, N° 133
D.O. 13.01.2000
definidos en este reglamento. La cantidad total de
azúcar o miel adicionada no podrá exceder de 200
g/kg calculados como extracto seco, en el producto
final;
c) el producto deberá tener el color, aroma y saborDTO 475, SALUD
Art. Unico, N° 133
D.O. 13.01.2000
DTO 475, SALUD
Art. Unico, N° 133
D.O. 13.01.2000
Art. Unico, N° 133
D.O. 13.01.2000
DTO 475, SALUD
Art. Unico, N° 133
D.O. 13.01.2000
característico de la fruta con que ha sido
elaborado.
d) ELIMINADA
Artículo 487.- Los valores mínimos de sólidosDTO 68, SALUD
Art. primero
Nº 32 a)
D.O. 23.01.2006 solubles en las frutas que se enuncian a continuación son referenciales: Frutas Sólidos solubles,
Art. primero
Nº 32 a)
D.O. 23.01.2006 solubles en las frutas que se enuncian a continuación son referenciales: Frutas Sólidos solubles,
% m/m mínimo
Boysenberry 10,0
Chirimoya 7,5DTO 68, SALUD
Art. primero
Nº 32 b)
D.O. 23.01.2006
Art. primero
Nº 32 b)
D.O. 23.01.2006
Ciruela 10,0
Damasco 10,0
Durazno 10,0
Frambuesa 10,0
Frutilla 6,0
Kiwi 8,0
Limón 6,0
Mango 10,0
Maracujá 6,0
Manzana 10,0
Melón 8,7DTO 68, SALUD
Art. primero
Nº 32 b)
D.O. 23.01.2006
Art. primero
Nº 32 b)
D.O. 23.01.2006
Membrillo 10,0
Naranja 9,0
Papaya 5,0
Pera 10,0
Piña 10,0
Pomelo 9,0
Tomate 6,0
Uva 13,0
En mezclas de frutas se deberá considerar como base la fruta que se encuentre en mayor proporción de acuerdo a lo declarado en la rotulación.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días después de su publicación.
Artículo 487 A.- Aguas envasadas, son aguasDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 potables tratadas que pueden ser o no purificadas (destilación, nanofiltración, osmosis inversa o cualquier otro método similar) y podrán ser coloreadas, saborizadas, carbonatadas, mineralizadas, y debiendo estar exentas de edulcorantes naturales y/o artificiales.
Art. primero Nº 33
D.O. 23.01.2006 potables tratadas que pueden ser o no purificadas (destilación, nanofiltración, osmosis inversa o cualquier otro método similar) y podrán ser coloreadas, saborizadas, carbonatadas, mineralizadas, y debiendo estar exentas de edulcorantes naturales y/o artificiales.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 B.- Las aguas envasadas sin gasDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 deberán ser sometidas a procesos necesarios para asegurar su calidad sanitaria, estos procesos pueden ser: ozonificación, UV o cualquier otro que asegure la inocuidad del producto envasado.
Art. primero Nº 33
D.O. 23.01.2006 deberán ser sometidas a procesos necesarios para asegurar su calidad sanitaria, estos procesos pueden ser: ozonificación, UV o cualquier otro que asegure la inocuidad del producto envasado.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 C.- Las aguas envasadas solo podránDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 expenderse cuando contengan electrolitos y deberán contener como mínimo 10 mg/l de sólidos totales.
Art. primero Nº 33
D.O. 23.01.2006 expenderse cuando contengan electrolitos y deberán contener como mínimo 10 mg/l de sólidos totales.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 D.- A las aguas envasadas se lesDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 podrán incorporar nutrientes, en concentraciones según la normativa respectiva. Los nutrientes incorporados a estas aguas no deberán estar comprendidos en los programas de Salud Pública, en este tipo de productos.
Art. primero Nº 33
D.O. 23.01.2006 podrán incorporar nutrientes, en concentraciones según la normativa respectiva. Los nutrientes incorporados a estas aguas no deberán estar comprendidos en los programas de Salud Pública, en este tipo de productos.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 E.- La rotulación de las aguasDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 envasadas deberá incluir, la composición y concentración de las sales minerales o electrolitos, según corresponda a su definición, la que será adicional a los requisitos de rotulación establecidos en el Título II Párrafo II del presente Reglamento.
Art. primero Nº 33
D.O. 23.01.2006 envasadas deberá incluir, la composición y concentración de las sales minerales o electrolitos, según corresponda a su definición, la que será adicional a los requisitos de rotulación establecidos en el Título II Párrafo II del presente Reglamento.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 F.- El anhídrido carbónico empleado enDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 la elaboración de aguas envasadas, debe contener un mínimo de 98% de este gas y no más de 0,2% de monóxido de carbono y estará exento de sustancias extrañas que le confieran olor y/o sabor desagradable o de cualquier otra naturaleza.
Art. primero Nº 33
D.O. 23.01.2006 la elaboración de aguas envasadas, debe contener un mínimo de 98% de este gas y no más de 0,2% de monóxido de carbono y estará exento de sustancias extrañas que le confieran olor y/o sabor desagradable o de cualquier otra naturaleza.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 488.- Los alimentos Decreto 24, SALUD
Art. 1 Nº 3
D.O. 24.11.2011para regímenes especiales son aquellos elaborados o preparados, especialmente, para satisfacer necesidades fisiológicas o fisiopatológicas, particulares de nutrición.
Art. 1 Nº 3
D.O. 24.11.2011para regímenes especiales son aquellos elaborados o preparados, especialmente, para satisfacer necesidades fisiológicas o fisiopatológicas, particulares de nutrición.
Los productos regulados por este artículo deberán formularse de acuerdo a principios médicos y nutricionales aceptados, científicamente reconocidos o consensuados internacionalmente y deberán satisfacer las necesidades particulares de nutrición que indica el productor. Se excluyen de esta categoría los alimentos de uso por vía parenteral, los que serán regulados por el decreto supremo Nº 1.876/05 del Ministerio de Salud.
Artículo 489.- Los alimentosDecreto 24, SALUD
Art. 1 Nº 4
D.O. 24.11.2011 para regímenes especiales, sin perjuicio del cumplimiento de las normas generales de etiquetado del presente reglamento, deberán indicar en la cara principal del envase la(s) característica(s) esencial(es) o modificación(es) realizada(s).
Art. 1 Nº 4
D.O. 24.11.2011 para regímenes especiales, sin perjuicio del cumplimiento de las normas generales de etiquetado del presente reglamento, deberán indicar en la cara principal del envase la(s) característica(s) esencial(es) o modificación(es) realizada(s).
La información y rotulación nutricional de los alimentos comprendidos en el párrafo II del presente Título, deberán expresarse por cada 100 g o 100 ml, según corresponda y por cada 100 kilocalorías (kcal) utilizables del producto, opcional por cada porción del producto listo para el consumo.
La información y rotulación nutricional de los alimentos comprendidos en el párrafo III del presente Título deberán expresarse por cada 100 g o 100 ml, según corresponda, y por cada porción del producto listo para el consumo, opcional por cada 100 kilocalorías (kcal) utilizables del producto.
La información y rotulación nutricional de los alimentos comprendidos en el párrafo V del presente Título deberán expresarse por cada 100 g o 100 ml, según corresponda, y por cada 100 kilocalorías (kcal) utilizables del producto, opcional por cada porción del producto listo para el consumo.
La información y rotulación nutricional de los alimentos para uso médico o medicinal para mayores de 36 meses deberá dar cumplimiento a lo establecido en el Título II del presente Reglamento.
Artículo 493.- Las fórmulas para lactantes son aquellos productos que satisfacen los requerimientos nutricionales de los lactantes, cuando la alimentación con leche materna no es posible o es insuficiente. Se entiende por lactantes a los niños no mayores de 12 meses de edad.
Artículo 494.- Las fórmulas para lactantes se clasifican en:
a) fórmula de iniciación es aquella que una vez reconstituida de acuerdo a las recomendaciones del fabricante está destinada a satisfacer todos los requerimientos nutricionales del lactante durante los primeros cuatro a seis meses de vida, aunque puede ser usada además de otros alimentos para lactantes hasta la edad de un año.
Aquella fórmula de iniciación que se le introduzca DTO 475, SALUD
Art. Unico, N° 136
D.O. 13.01.2000alguna modificación en el contenido y composición de los nutrientes que la hagan más semejante a la leche materna se denominará fórmula de iniciación adaptada;
Art. Unico, N° 136
D.O. 13.01.2000alguna modificación en el contenido y composición de los nutrientes que la hagan más semejante a la leche materna se denominará fórmula de iniciación adaptada;
La relación lactoalbúmina/caseína deberá tener una proporción Decreto 24, SALUD
Art. 1 Nº 6
D.O. 24.11.2011 mínima de 60:40% respectivamente.
Art. 1 Nº 6
D.O. 24.11.2011 mínima de 60:40% respectivamente.
b) fórmula de continuación es aquella que forma parte DTO 475, SALUD
Art. Unico, N° 136
D.O. 13.01.2000de un esquema de alimentación mixto destinada al consumo de los lactantes de más de seis meses de edad.
Art. Unico, N° 136
D.O. 13.01.2000de un esquema de alimentación mixto destinada al consumo de los lactantes de más de seis meses de edad.
c) fórmulas para lactantes con necesidades nutricionales especiales, tales como, intolerancia Decreto 106, SALUD
Art. 1 Nº 33
D.O. 23.04.2009a la lactosa, intolerancia al gluten, fenilcetonuria u otros problemas metabólicos. Éstas deberán indicar en el rótulo en forma clara y destacada la necesidad especial para la que debe emplearse, las propiedades específicas en que se basa y recomendaciones concretas y advertencias en relación a su consumo, si fuese necesario.
Art. 1 Nº 33
D.O. 23.04.2009a la lactosa, intolerancia al gluten, fenilcetonuria u otros problemas metabólicos. Éstas deberán indicar en el rótulo en forma clara y destacada la necesidad especial para la que debe emplearse, las propiedades específicas en que se basa y recomendaciones concretas y advertencias en relación a su consumo, si fuese necesario.
Artículo 495.- La fórmula de iniciación reconstituida deberá presentar la siguiente composición básica:
a) energía: mínimo 60 kcal/100 ml
máximo 70 kcal/100 ml
b) proteínas: mínimo 1,8 g/100 kcal
máximo 3,0 g/100 kcal
El índice químico de las proteínas presentes será equivalente, por lo menos, al 85% de las proteínas de referencia (leche humana). No obstante, para efectos de cálculo, podrán sumarse las concentraciones de metionina y cistina.
Contenido de aminoácidos de la leche humana
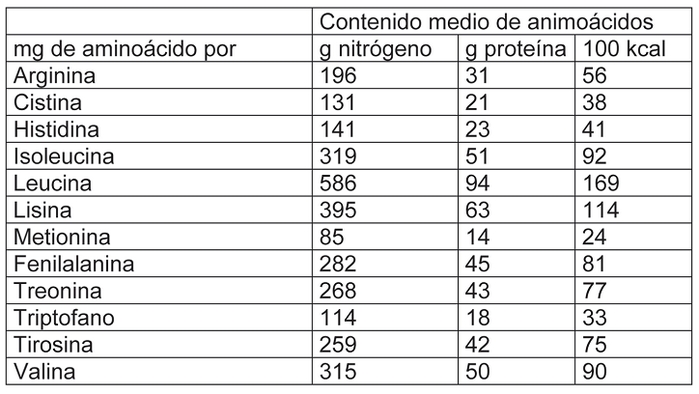
c) lípidos: mínimo: 4,4 g/100 kcal
máximo: 6,0 g/100 kcal
-ácido linoleico: (en forma de linoleatos)
mínimo: 300 mg/100 kcal
máximo: 1400 mg/100 kcal
- ácido α linolénico:
mínimo: 50 mg/100 kcal
máximo: NE (No Especificado)
Proporción de ácido linoleico/ α linolénico
mínimo 5:1
máximo 15:1
Se prohíbe la utilización de aceite de sésamo y aceite de algodón.
Los ácidos láurico y mirístico en conjunto no deberán superar el 20% del contenido total de ácidos grasos.
El contenido de ácidos grasos trans no deberá ser superior al 3% del contenido total de ácidos grasos.
El contenido de ácido erúcico no deberá superar el 1% del contenido total de ácidos grasos.
El contenido total de fosfolípidos no deberá superar los 300 mg/100 kcal.
En los preparados para lactantes no se utilizarán aceites y grasas hidrogenadas comercialmente.
d) carbohidratos: mínimo: 9g/100 kcal
máximo: 14g/100 kcal
e) sales minerales por cada 100 kcal utilizables:
Mín. Máx.
Sodio (mg) 20 60
Potasio (mg) 60 180
Cloro (mg) 50 160
Calcio (mg) 50 140
Fósforo (mg) 25 100
Magnesio (mg) 5 15
Zinc (mg) 0,5 1,5
Cobre (mcg) 35 120
Yodo (mcg) 10 60
Manganeso (mcg) 1 100
Selenio (mcg) 1 9
relación calcio/fósforo 1:1 2:1
En el caso de las fórmulas en que se haya agregado hierro, los límites aplicables serán los siguientes
Mín. Máx.
Hierro (mg) 0,45 3
f) vitaminas por cada 100 kcal utilizables
Mín. Máx.
Vitamina A (mcg retinol) 60 180
Vitamina D
(mcg colecalciferol) 1 2,5
Tiamina (mcg) 60 300
Riboflavina (mcg) 80 500
Nicotinamida
(mcg niacina) 300 1500
Ácido pantoténico (mcg) 400 2000
Vitamina B6 (mcg) 35 175 los preparados
deberán contener
un mínimo de 15
mcg de vitamina
B6/g de proteína
Biotina (mcg) 1,5 10
Ácido fólico (mcg) 10 50
Vitamina B12 (mcg) 0,1 1,5
Vitamina C (mg) 10 70
Vitamina K (mcg) 4 27
Vitamina E (mg-tocoferol) 0,5 5 mg/g de ácidos
grasos
poliinsaturados
expresados como
ácido linoleico.
En ningún caso
será inferior a
0,5 mg/100 kcal
disponibles.
g) Otras sustancias: Decreto 106, SALUD
Art. 1 Nº 34
D.O. 23.04.2009Decreto 24, SALUD
Art. 1 Nº 7
D.O. 24.11.2011por cada 100 kcal.
Art. 1 Nº 34
D.O. 23.04.2009Decreto 24, SALUD
Art. 1 Nº 7
D.O. 24.11.2011por cada 100 kcal.
Mín. Máx.
Colina (mg) 7 50
mioinositol (mg) 4 40
L- carnitina (mg) 1,2 NE
h) Ingredientes facultativos:
Mín. Máx.
h.1) Taurina (mg) por cada 100 kcal - 12
h.2) Ac. Docosahexaenoico (% total de lípidos) - 0,5
Cuando se use ácido Docosahexaenoico (DHA) (22:6-3) en los preparados para lactantes, el contenido de ácido araquidónico (20:4n-6) deberá alcanzar, por lo menos, la misma concentración que el DHA.
Mín. Máx.
h.3) Nucleótidos: mg/100 Kcal - 16
i) Aditivos
Sólo se podrán usar los siguientes aditivos en las cantidades señaladas:
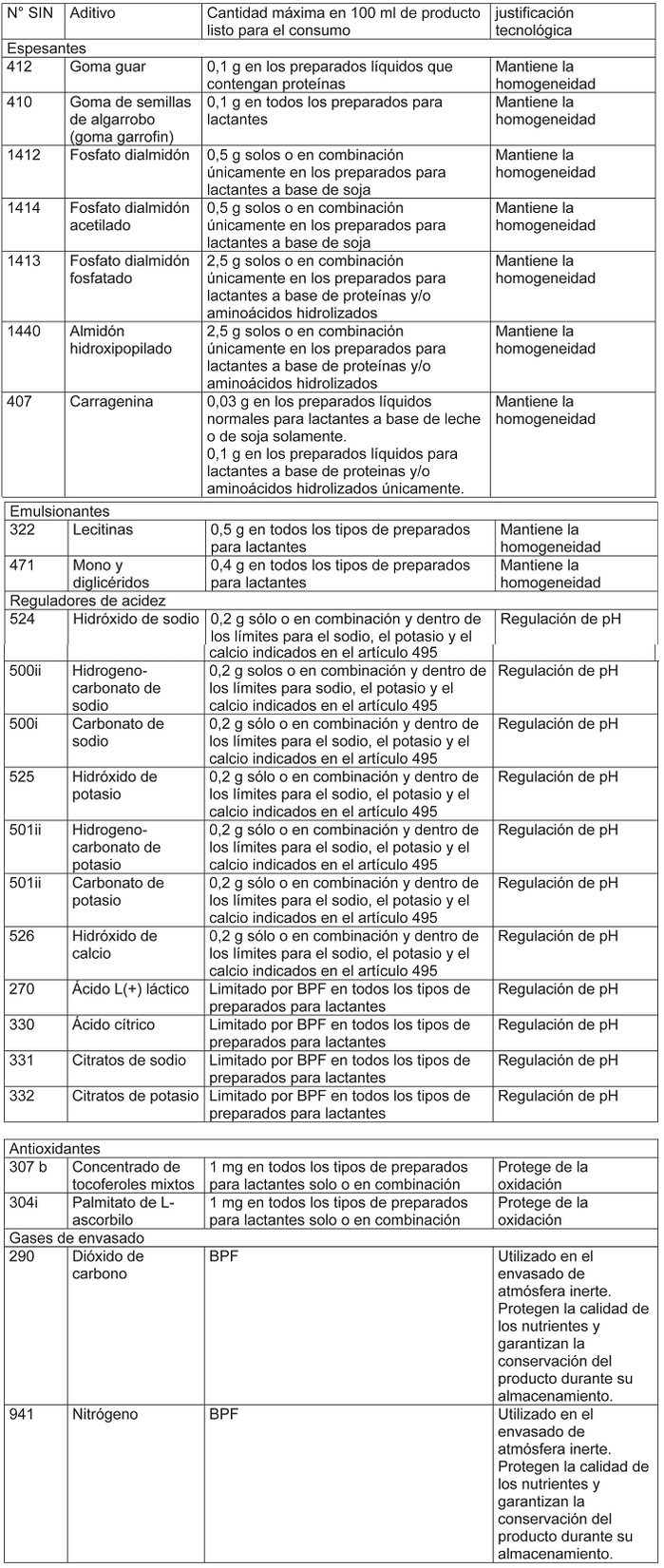
Decreto 106, SALUD
Art. 1 Nº 35
D.O. 23.04.2009 Artículo 496.- La fórmula de continuación reconstituida deberá presentar la siguiente composición básica:
Art. 1 Nº 35
D.O. 23.04.2009 Artículo 496.- La fórmula de continuación reconstituida deberá presentar la siguiente composición básica:
a) energía: mínimo 60 kcal/100 ml
máximo 85 kcal/100 ml
b) proteínas: mínimo 3 g/100 kcal
máximo 5,5 g/100 kcal
c) lípidos: mínimo 3,0 g/100 kcal
máximo 6,0 g/100 kcal
-ácido linoleico:
mínimo : 300 mg/100 kcal
máximo : 1400 mg/100Kcal.
- ácido α-linolénico
mínimo : 50 mg/100 kcal
máximo : N.E. (No Especificado)
Proporción de ácido linoleico/ α-linolénico
mínimo 5:1
máximo 15:1
Se prohíbe la utilización de aceite de sésamo y aceite de algodón
Los ácidos láurico y mirístico en conjunto no deberán superar el 20% del contenido total de ácidos grasos.
El contenido de ácidos grasos trans no deberá ser superior al 3% del contenido total de ácidos grasos.
El contenido de ácido erúcico no deberá superar el 1% del contenido total de ácidos grasos.
El contenido total de fosfolípidos no deberá superar los 300 mg/100 kcal.
En los preparados para lactantes no se utilizarán aceites y grasas hidrogenadas comercialmente
d) carbohidratos: mínimo 7 g/100 kcal.
máximo 14 g/100 kcal.
-Lactosa: mínimo 1,8 g/100 kcal.
-Sacarosa,
glucosa, fructosa,
miel: máximo 20% del contenido total
de carbohidratos por separado o
en conjunto.
e) sales minerales por cada 100 kcal utilizables:Decreto 117, SALUD
Art. 1 N° 1
D.O. 17.09.2014
Art. 1 N° 1
D.O. 17.09.2014
Mín. Máx.
Hierro (mg) 0,45 3
Sodio (mg) 20 60
Potasio (mg) 60 180
Cloro (mg) 50 160
Calcio (mg) 50 140
Fósforo (mg) 25 100
Magnesio (mg) 5 15
Zinc (mg) 0,5 1,5
Cobre (mcg) 35 120
Yodo (mcg) 10 60
Manganeso (mcg) 1 100
Selenio (mcg) 1 9
Mín. Máx.
Relación
calcio/fósforo 1:1 2:1
f) vitaminas por cada 100 kcal utilizables.
Mín. Máx.
Vitamina A
(mcg retinol) 75 225
Vitamina D
(mcg colecalciferol) 1 3
Tiamina (mcg) 40 300
Riboflavina (mcg) 60 500
Nicotinamida
(mcg niacina) 250 1500
Ácido pantoténico
(mcg) 300 2000
Vitamina B6 (mcg) 45 175
los preparados
deberán contener un
mínimo de 15 mcg de
vitamina B6/g de
proteína
Biotina (mcg) 1,5 10
Ácido fólico (mcg) 4 50
Vitamina B12 (mcg) 0,2 1,5
Vitamina C (mg) 8 70
Vitamina K (mcg) 4 27
Vitamina E
(mg-tocoferol) 0,5 5 mg/g de ácidos grasos
poliinsaturados
expresados como
ácido linoleico.
En ningún caso será
inferior a 0,5
mg/100 kcal
disponibles.
g) Otras sustancias: Decreto 24, SALUD
Art. 1 Nº 8
D.O. 24.11.2011por cada 100 kcal.
Art. 1 Nº 8
D.O. 24.11.2011por cada 100 kcal.
Mín. Máx.
Mioinositol (mg) 4 40
L- carnitina (mg) 1,2 NE
h) Ingredientes facultativos
Min. Máx.
h.1) Taurina (mg) por cada 100 kcal - 12
h.2) Ac. Docosahexaenoico (% total de lípidos) - 0,5
Cuando se use ácido Docosahexaenoico (DHA) (22:6-3) en los preparados para lactantes, el contenido de ácido araquidónico (20:4n-6) deberá alcanzar, por lo menos, la misma concentración que el DHA.
Mín. Máx.
h.3) Nucleótidos: mg/100 Kcal - 16
i) aditivos.
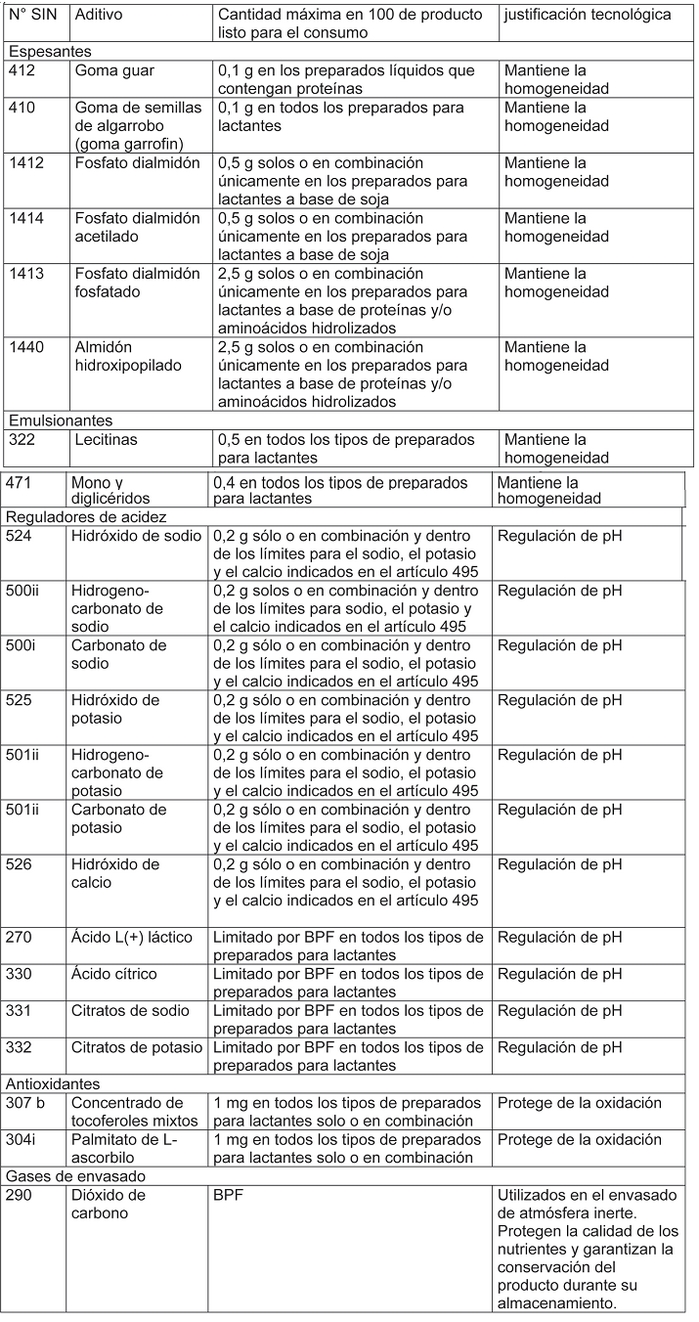
Decreto 106, SALUD
Art. 1 Nº 36
D.O. 23.04.2009 Artículo 497.- Además de lo dispuesto en el presente reglamento para etiquetado general y para regímenes especiales, en la rotulación y/o publicidad de cualquier tipo de las fórmulas para lactantes sólo podrá proveerse la siguiente información, la que, además, tiene el carácter de obligatoria:
Art. 1 Nº 36
D.O. 23.04.2009 Artículo 497.- Además de lo dispuesto en el presente reglamento para etiquetado general y para regímenes especiales, en la rotulación y/o publicidad de cualquier tipo de las fórmulas para lactantes sólo podrá proveerse la siguiente información, la que, además, tiene el carácter de obligatoria:
a) origen de las proteínas que contiene el producto. Si el 90% de las proteínas como mínimo, procede de leche deberá denominarse "Fórmula para lactantes a base de leche"; si el producto no contiene leche ni ninguno de sus derivados deberá indicarse "no contiene leche ni productos lácteos".
b) rotulación del valor energético disponible (expresado en kcal), contenido de proteínas, lípidos y carbohidratos disponibles (expresados en gramos), los que deberán expresarse según Artículo 491 del presente Reglamento.
c) rotulación de otros nutrientes opcionales, los que deberán rotularse de acuerdo al Artículo 491 del presente reglamento
d) los productos que contengan un mínimo de 1 mg de hierro por 100 kcal utilizables deberán tener la denominación "Fórmula con hierro para lactantes".
e) deberá indicarse en caracteres destacados que la fórmula "NO SUSTITUYE A LA LECHE MATERNA".
f) En la rotulación y publicidad de las fórmulas para lactantes queda totalmente prohibido el uso de los términos "humanizada", "maternalizada" u otros similares y de imágenes que puedan inducir a la indebida comparación con la lactancia materna o a desalentar su práctica, como por ejemplo, lactantes, mujeres, biberones, entre otros.
g) Asimismo la etiqueta de cada envase deberá contener un mensaje claro, visible y fácilmente legible que incluya las palabras "AVISO IMPORTANTE: LA LECHE MATERNA ES EL MEJOR ALIMENTO PARA SU NIÑO/A" o una declaración equivalente que exprese inequívocamente la superioridad de la leche materna por sobre las fórmulas para lactantes.
h) Deberá advertirse la necesidad de combinar el alimento para lactantes con alimentación complementaria adecuada al desarrollo del menor, a partir de los 6 meses de edad.
i) el producto destinado a lactantes con necesidades especiales de nutrición, deberá indicar la necesidad especial para la que va a emplearse la fórmula y la propiedad o las propiedades dietéticas en que se basa.
j) Deberá informarse que el producto debe ser usado únicamente bajo indicación de un profesional de la salud.
k) Deberá rotularse, además, la fecha de elaboración y la fecha de vencimiento e instrucciones sobre su correcta preparación y uso, así como su almacenamiento y conservación antes y después de abrir el envase.
Artículo 498.- Preparaciones comerciales deDTO 475, SALUD
Art. Unico, N° 140
D.O. 13.01.2000 alimentos infantiles son aquellas utilizadas preferentemente durante el período normal de destete y durante la adaptación de los lactantes y niños hasta los 36 meses de edad a la alimentación normalDecreto 106, SALUD
Art. 1 Nº 37
D.O. 23.04.2009. Se preparan ya sea para ser administrados directamente, o bien, deshidratados para ser reconstituidos mediante dilución en agua. Estos alimentos pueden presentarse como sopas, guisos, postres y jugos.
Art. Unico, N° 140
D.O. 13.01.2000 alimentos infantiles son aquellas utilizadas preferentemente durante el período normal de destete y durante la adaptación de los lactantes y niños hasta los 36 meses de edad a la alimentación normalDecreto 106, SALUD
Art. 1 Nº 37
D.O. 23.04.2009. Se preparan ya sea para ser administrados directamente, o bien, deshidratados para ser reconstituidos mediante dilución en agua. Estos alimentos pueden presentarse como sopas, guisos, postres y jugos.
Artículo 499.- Las preparaciones comerciales de alimentos infantiles para administrarse directamente según el tamaño de partículas se clasifican en:
a) colados : aquellas preparaciones de textura fina y homogénea, que contiene partículas pequeñas, de tamaño uniforme y que no requieren ni incitan a la masticación antes de la deglución;
b) picados : aquellas preparaciones de partículas más grandes y textura más gruesa, incluyendo trocitos de alimentos que incitan a la masticación.
Artículo 500.- Los alimentos infantiles deshidratados, una vez reconstituidos serán parecidos en cuanto a consistencia y tamaño de sus partículas a los descritos en a) y b) del artículo anterior.
Artículo 501.- Estos alimentos infantiles deben prepararse principalmente a base de frutas, verduras, carnes, pescado y huevos y puede agregarse cereales, productos lácteos y materias grasas.
Artículo 502.- Estos alimentos deberán presentar la siguiente composición básica:
a) energía : mínimo 70 kcal/100 g con
excepción de los postres y
mínimo 60 kcal/100 g para
colados y picados de
verduras.
b) proteínas : mínimo 4,2 g/100 kcal ( en mezclas aDTO 475, SALUD
Art. Unico, N° 1
D.O. 13.01.2000
Art. Unico, N° 1
D.O. 13.01.2000
base de carnes y pescado )
: mínimo 2,8 g/100 kcal ( en mezclas a
base de verduras, hortalizas y
cereales;
c) materia grasa: Se prohíbe la utilización de aceite de sésamo y aceite de algodón. Los ácidos láurico y mirístico en conjunto no deberán superar el 20% del contenido total de ácidos grasosDecreto 106, SALUD
Art. 1 Nº 38
D.O. 23.04.2009. El contenido de ácidos grasos trans no deberá ser superior al 3% del contenido total de ácidos grasos. El contenido de ácido erúcico no deberá superar el 1% del contenido total de ácidos grasos. El contenido total de fosfolípidos no deberá superar los 300mg/100kcal.
Art. 1 Nº 38
D.O. 23.04.2009. El contenido de ácidos grasos trans no deberá ser superior al 3% del contenido total de ácidos grasos. El contenido de ácido erúcico no deberá superar el 1% del contenido total de ácidos grasos. El contenido total de fosfolípidos no deberá superar los 300mg/100kcal.
d) sodio : máximo 10 meq/100 kcalDTO 475, SALUD
Art. Unico, N° 141
D.O. 13.01.2000
Art. Unico, N° 141
D.O. 13.01.2000
(230 mg/100 kcal).
No se permitirá la adición de
sal (NaCI) a los productos de
postre a base de frutas.
La cantidad de sodio
provenientes de diferentes
sales minerales quedarán
dentro del límite establecido
para sodio;
e) vitaminas y sales
minerales : podrá agregarse en conformidad con las listas
de referencia del artículo 496 e) y f);
f) fibra dietaria
total : máximo 2,0 g/100 g de producto
DTO 475, SALUD
Art. Unico, N° 141
D.O. 13.01.2000 listo para el consumo.
Art. Unico, N° 141
D.O. 13.01.2000 listo para el consumo.
Decreto 106, SALUD
Art. 1 Nº 39
D.O. 23.04.2009 Artículo 503.- Sólo se permitirá el uso de los siguientes aditivos, en la cantidad que se indica por 100 g del producto listo para el consumo:
Art. 1 Nº 39
D.O. 23.04.2009 Artículo 503.- Sólo se permitirá el uso de los siguientes aditivos, en la cantidad que se indica por 100 g del producto listo para el consumo:
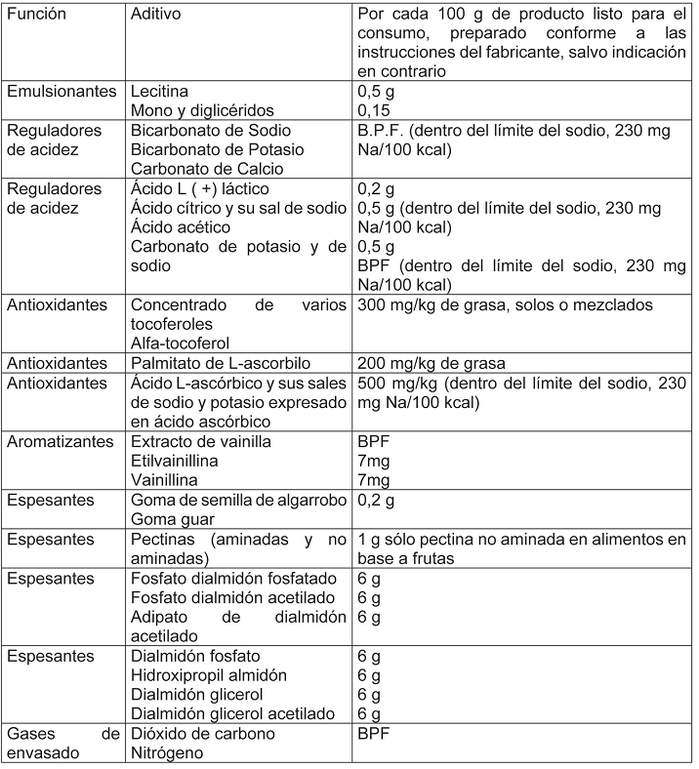
Artículo 504.- El contenido máximo de nitratos en este tipo de alimentos deberá ser inferior a 250 mg/kg expresado como nitratos.
Artículo 505.- Además de lo dispuesto paraDTO 475, SALUD
Art. Unico, N° 143
D.O. 13.01.2000 etiquetado general y para régimenes especiales las preparaciones comerciales de alimentos infantiles deberán indicar en su etiqueta lo siguiente:
Art. Unico, N° 143
D.O. 13.01.2000 etiquetado general y para régimenes especiales las preparaciones comerciales de alimentos infantiles deberán indicar en su etiqueta lo siguiente:
a) Para niños mayores de seis meses'';
b) fecha de elaboración y fecha de vencimiento;
c) instrucciones sobre su preparación y uso, así como su almacenamiento y conservación antes y después de abrir el envase.
En este tipo de productos, no deberán incorporarse en los rótulos ni publicidad de los mismos, declaraciones de propiedades saludables.
Los alimentos Decreto 24, SALUD
Art. 1 Nº 9
D.O. 24.11.2011 infantiles no deberán formularse con hierbas o sus extractos u otros componentes que induzcan el sueño en los menores o con el propósito de reducir el meteorismo o dolores abdominales o hinchazón, ni otros fines terapéuticos
Art. 1 Nº 9
D.O. 24.11.2011 infantiles no deberán formularse con hierbas o sus extractos u otros componentes que induzcan el sueño en los menores o con el propósito de reducir el meteorismo o dolores abdominales o hinchazón, ni otros fines terapéuticos
Decreto 106, SALUD
Art. 1 Nº 40
D.O. 23.04.2009 Artículo 506.- Los alimentos para uso infantil procesados a base de cereales son aquellos destinados a completar el régimen alimentario normal de niños desde los 6 meses hasta los 36 meses de edad.
Art. 1 Nº 40
D.O. 23.04.2009 Artículo 506.- Los alimentos para uso infantil procesados a base de cereales son aquellos destinados a completar el régimen alimentario normal de niños desde los 6 meses hasta los 36 meses de edad.
Decreto 106, SALUD
Art. 1 Nº 41
D.O. 23.04.2009 Artículo 507.- Los alimentos elaborados a base de cereales están preparados principalmente con uno o más cereales molidos que se procesan para lograr un escaso contenido de humedad y se fragmentan para ser consumidos diluidos con agua, leche u otro líquido conveniente o sin dilución como galletas, bizcochos o pastas y se consumen de acuerdo a las instrucciones que el fabricante debe indicar en el rótulo del producto.
Art. 1 Nº 41
D.O. 23.04.2009 Artículo 507.- Los alimentos elaborados a base de cereales están preparados principalmente con uno o más cereales molidos que se procesan para lograr un escaso contenido de humedad y se fragmentan para ser consumidos diluidos con agua, leche u otro líquido conveniente o sin dilución como galletas, bizcochos o pastas y se consumen de acuerdo a las instrucciones que el fabricante debe indicar en el rótulo del producto.
El contenido de cereales en el producto deberá alcanzar por lo menos el 25 por ciento de la mezcla final en relación con el peso en seco. De acuerdo a su preparación se distinguen las siguientes categorías:
a) Productos que consisten en cereales que se preparan para el consumo añadiendo leche u otros líquidos nutritivos idóneos.
b) Cereales con adición de alimentos de alto valor proteínico, que se preparan para el consumo con agua u otros líquidos apropiados exentos de proteínas.
Decreto 106, SALUD
Art. 1 Nº 42
D.O. 23.04.2009 Artículo 508.- Las categorías descritas en artículo 507 se preparan principalmente con uno o más productos molidos de cereales, como trigo, arroz, cebada, avena, centeno, maíz o sorgo. También podrán contener leguminosas previamente tratadas para eliminar factores antinutricionales (según las buenas prácticas de fabricación), raíces amiláceas como arroz o mandioca, tallos amiláceos y semillas oleaginosas en menor proporción.
Art. 1 Nº 42
D.O. 23.04.2009 Artículo 508.- Las categorías descritas en artículo 507 se preparan principalmente con uno o más productos molidos de cereales, como trigo, arroz, cebada, avena, centeno, maíz o sorgo. También podrán contener leguminosas previamente tratadas para eliminar factores antinutricionales (según las buenas prácticas de fabricación), raíces amiláceas como arroz o mandioca, tallos amiláceos y semillas oleaginosas en menor proporción.
Decreto 106, SALUD
Art. 1 Nº 43
D.O. 23.04.2009 Artículo 509.- Los requisitos relativos al contenido energético y de nutrientes se refieren al producto listo para el consumo tal como se vende, o preparado de conformidad con las instrucciones del fabricante, a menos que se especifique otra cosa y deberán ajustarse a lo siguiente:
Art. 1 Nº 43
D.O. 23.04.2009 Artículo 509.- Los requisitos relativos al contenido energético y de nutrientes se refieren al producto listo para el consumo tal como se vende, o preparado de conformidad con las instrucciones del fabricante, a menos que se especifique otra cosa y deberán ajustarse a lo siguiente:
Contenido energético
El contenido energético de los alimentos elaborados a base de cereales no deberá ser inferior a 0,8 kcal/g.
Proteínas
En aquellos que se consumen de acuerdo a lo descrito en el punto b) del art. 507, el índice químico de la proteína añadida deberá ser equivalente por lo menos al 80 por ciento de la calidad de la caseína. El contenido de proteína no deberá ser inferior a 2 g/100 kcal ni superior a 5,5 g/100 kcal.
Se permite la adición de aminoácidos sólo con el fin de mejorar el valor nutricional de la mezcla proteínica y en las proporciones necesarias para tal fin. Podrán emplearse únicamente formas naturales de L-aminoácidos.
Lípidos
Para los productos mencionados en punto b) del artículo 507, el contenido de lípidos no deberá ser superior a 4,5 g/100 kcal. Sin embargo, si el contenido de lípidos es superior a 3,3 g/100 kcal:
- la cantidad de ácido linoleico (en forma de triglicéridos = linoleatos) no deberá ser inferior a 300 mg/100 kcal. ni superior a 1200 mg/100 kcal.
- la cantidad de ácido láurico no deberá exceder del 15% del contenido lipídico total;
- la cantidad de ácido mirístico no deberá exceder del 15% del contenido lipídico total.
Las categorías de productos a que se refiere la letra a) del artículo 507 no deberán exceder de un contenido máximo de lípidos de 3,3 g/100 kcal.
Hidratos de Carbono
Si a los productos mencionados en el punto a) artículo 507 se añade sacarosa, fructosa, glucosa, jarabe de glucosa o miel:
- la cantidad de carbohidratos añadidos procedentes de estas fuentes no deberá ser superior a 7,5 g/100 kcal
- la cantidad de fructosa añadida no deberá ser superior a 3,75 g/100 kcal.
Si a los productos mencionados en el punto b) del artículo 507 se añade sacarosa, fructosa, glucosa, jarabe de glucosa o miel:
- la cantidad de carbohidratos añadidos procedentes de estas fuentes no deberá ser superior a 5 g/100 kcal.
- la cantidad de fructosa añadida no deberá ser superior a 2,5 g/100 kcal.
Minerales
- El contenido de calcio de los productos mencionados en el punto b) del artículo 507 no deberá ser inferior a 80 mg/100 kcal.
- El contenido de sodio de los productos descritos en el artículo 507 podrá ser como máximo de 100 mg/100 Kcal del producto listo para el consumo.
Vitaminas
La cantidad de vitamina B1 (tiamina) no deberá ser inferior a 50 mcg/100 kcal.
En lo que respecta a los productos mencionados en punto b) del artículo 507 la cantidad de vitamina A y de vitamina D deberá mantenerse dentro de los límites siguientes:
Vitamina
mcg/100 kcl
Vitamina A (en mcg de 60 - 180
retinol equivalente)
Vitamina D 1 - 3
Los productos señalados en el punto a) del artículo 507 a los que se adicione vitamina A o vitamina D deberán cumplir con los límites de esas vitaminas descritos para los productos mencionados en la letra f) del artículo 496.
Las vitaminas y minerales no mencionados en el presente artículo podrán ser agregadas de acuerdo a los límites establecidos en el artículo 496 del presente reglamento.
Humedad
El contenido de humedad de los productos deberá ser conforme a las buenas prácticas de fabricación para cada una de las categorías de productos, y su cuantía deberá ser tal que se reduzca al mínimo la pérdida de valor nutritivo y no pueda haber multiplicación de microorganismos.
Decreto 106, SALUD
Art. 1 Nº 44
D.O. 23.04.2009 Artículo 510.- Tanto el producto como sus componentes no deberán haberse tratado con radiaciones ionizantes.
Art. 1 Nº 44
D.O. 23.04.2009 Artículo 510.- Tanto el producto como sus componentes no deberán haberse tratado con radiaciones ionizantes.
Queda prohibido el uso de grasas hidrogenadas y parcialmente hidrogenadas en estos productos.
El contenido máximo de fibra dietaria total será de 2g/100g de producto listo para el consumo conforme a las instrucciones sugeridas por el fabricante.
Decreto 106, SALUD
Art. 1 Nº 45
D.O. 23.04.2009 Artículo 511.- Todos los ingredientes, incluso los facultativos, deberán estar limpios y ser inocuos, apropiados y de buena calidad.
Art. 1 Nº 45
D.O. 23.04.2009 Artículo 511.- Todos los ingredientes, incluso los facultativos, deberán estar limpios y ser inocuos, apropiados y de buena calidad.
Todos los procedimientos de elaboración y desecación deberán llevarse a cabo de forma que sean mínimas las pérdidas del valor nutritivo, especialmente en la calidad de sus proteínas.
Los productos que contengan miel o jarabe de arce deberán tratarse de manera que se destruyan las esporas de Clostridium botulinum, si las hubiere.
Sólo podrán utilizarse cultivos productores de ácido láctico.
Decreto 106, SALUD
Art. 1 Nº 46
D.O. 23.04.2009 Artículo 512.- Sólo se permitirá el uso de los siguientes aditivos y en las cantidades indicadas por cada 100 g de producto listo para el consumo, preparado conforme a las instrucciones del fabricante, salvo indicación contraria de su médico.
Art. 1 Nº 46
D.O. 23.04.2009 Artículo 512.- Sólo se permitirá el uso de los siguientes aditivos y en las cantidades indicadas por cada 100 g de producto listo para el consumo, preparado conforme a las instrucciones del fabricante, salvo indicación contraria de su médico.
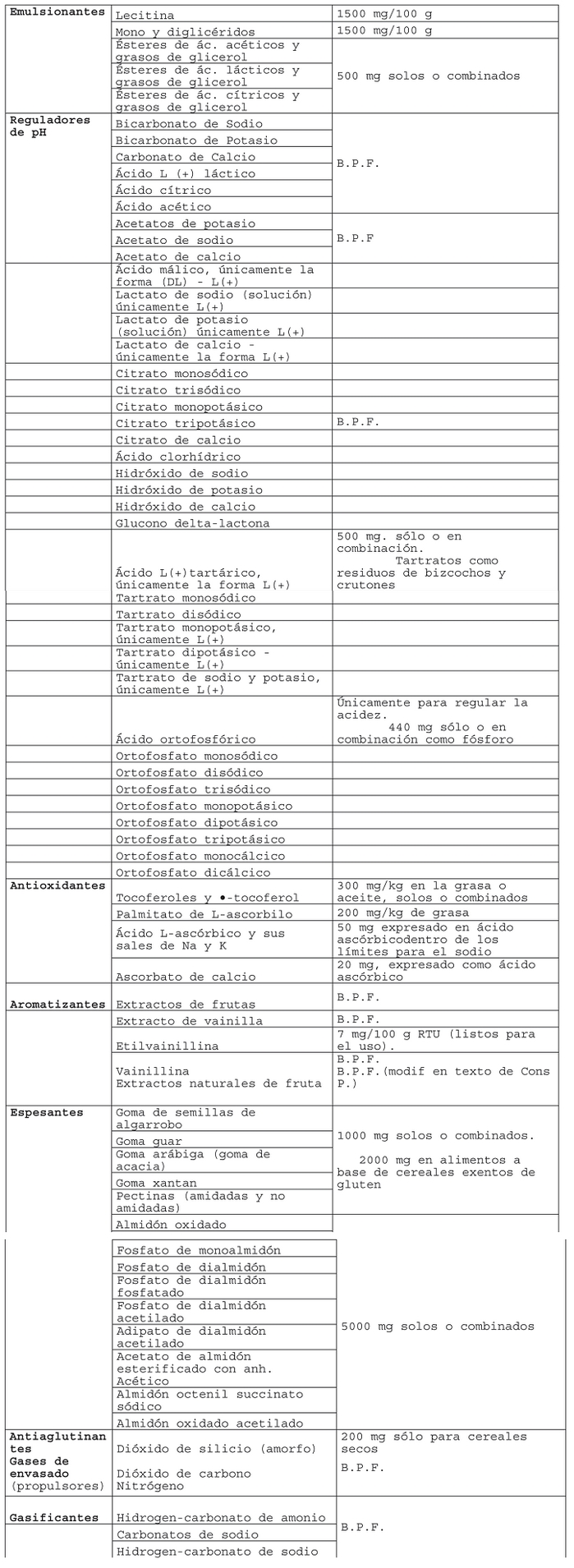
Decreto 106, SALUD
Art. 1 Nº 47
D.O. 23.04.2009 Artículo 513.- Además de lo dispuesto para etiquetado general y para regímenes especiales en el artículo 491 en la etiqueta de estos alimentos se indicará lo siguiente:
Art. 1 Nº 47
D.O. 23.04.2009 Artículo 513.- Además de lo dispuesto para etiquetado general y para regímenes especiales en el artículo 491 en la etiqueta de estos alimentos se indicará lo siguiente:
- la frase "para niños mayores de seis meses";
- Instrucciones sobre su preparación y uso, así como de su almacenamiento y conservación;
- Cuando el producto no haya sido fabricado para ser preparado acorde a lo descrito en el punto b) del artículo 507, deberá indicar el uso de leche para diluirlo o mezclarlo.
- Si el producto contiene cacao se indicará "Para niños mayores de 12 meses de edad".
Los productos contenidos en este párrafo no son sustitutos de la leche materna y no deberán presentarse como tales ni podrán declarar propiedades saludables.
Artículo 514.- Un alimentoDecreto 24, SALUD
Art. 1 Nº 10
D.O. 24.11.2011 de uso médico o medicinal es una categoría de alimentos para regímenes especiales, formulados, elaborados y presentados especialmente para el tratamiento dietético exclusivo o parcial de pacientes, y que deberán utilizarse bajo la supervisión de un profesional de la salud.
Art. 1 Nº 10
D.O. 24.11.2011 de uso médico o medicinal es una categoría de alimentos para regímenes especiales, formulados, elaborados y presentados especialmente para el tratamiento dietético exclusivo o parcial de pacientes, y que deberán utilizarse bajo la supervisión de un profesional de la salud.
Estos alimentos deberán rotular:
- que el producto debe utilizarse bajo supervisión médica o de un profesional de la salud,
- si el producto es o no adecuado para ser consumido como única fuente de alimento,
- si el producto va destinado a un grupo de edad específico, y
- si el producto puede perjudicar la salud de las personas que lo consuman sin estar afectados por alguna de las enfermedades, trastornos o afecciones, para los que vaya destinado.
Artículo 515.- Estos alimentos Decreto 24, SALUD
Art. 1 Nº 10
D.O. 24.11.2011se clasificarán de acuerdo a las instrucciones del fabricante en:
Art. 1 Nº 10
D.O. 24.11.2011se clasificarán de acuerdo a las instrucciones del fabricante en:
a) Alimentos completos con una formulación de nutrientes específica adaptada para determinadas enfermedades, trastornos o situaciones fisiológicas. Pueden constituir la única fuente de alimentos para las personas a las que van destinados. Estos alimentos también pueden utilizarse como sustitutos de una parte del régimen alimentario.
b) Alimentos incompletos con una formulación de nutrientes específica adaptada para determinadas enfermedades, trastornos o afecciones. No son adecuados como única fuente de alimentos, por lo que sólo pueden utilizarse como sustitutos de una parte del régimen alimentario.
Esta información deberá quedar, claramente, indicada en el rótulo para contribuir al uso adecuado del producto.
Decreto 106, SALUD
Art. 1 Nº 48
D.O. 23.04.2009 Artículo 516.- Un alimento libre de gluten es aquel que está preparado únicamente con ingredientes que por su origen natural y por la aplicación de buenas prácticas de fabricación - que impidan la contaminación cruzada - no contiene prolaminas procedentes de trigo, de todas las especies de triticum como la escaña común (Triticum spelta L.), el kamut (Triticum polonicum L.), trigo duro, centeno, cebada, ni sus variedades cruzadas, así como también de la avena.
Art. 1 Nº 48
D.O. 23.04.2009 Artículo 516.- Un alimento libre de gluten es aquel que está preparado únicamente con ingredientes que por su origen natural y por la aplicación de buenas prácticas de fabricación - que impidan la contaminación cruzada - no contiene prolaminas procedentes de trigo, de todas las especies de triticum como la escaña común (Triticum spelta L.), el kamut (Triticum polonicum L.), trigo duro, centeno, cebada, ni sus variedades cruzadas, así como también de la avena.
Para efectos de la inclusión en el rótulo de la leyenda "Libre de Gluten", los elaboradores de alimentos libres de gluten deberán cumplir con las exigencias establecidas en el presente Reglamento, así como contar con un programa de buenas prácticas de fabricación, con el fin de asegurar la no contaminación con los derivados de trigo, centeno, cebada y avena en los procesos, desde la recepción de las materias primas hasta la comercialización del producto final.
Decreto 106, SALUD
Art. 1 Nº 49
D.O. 23.04.2009 Artículo 517.- Las harinas libres de gluten destinadas a la panificación, así como el pan libre de gluten, deberán contener las vitaminas y minerales establecidas en el artículo 350 de este Reglamento. Todos los alimentos libres de gluten deberán etiquetarse nutricionalmente de acuerdo a lo establecido en el etiquetado general y en el artículo correspondiente de este Reglamento.
Art. 1 Nº 49
D.O. 23.04.2009 Artículo 517.- Las harinas libres de gluten destinadas a la panificación, así como el pan libre de gluten, deberán contener las vitaminas y minerales establecidas en el artículo 350 de este Reglamento. Todos los alimentos libres de gluten deberán etiquetarse nutricionalmente de acuerdo a lo establecido en el etiquetado general y en el artículo correspondiente de este Reglamento.
Decreto 134, SALUD
Art. 1 N° 2
D.O. 14.01.2015 Artículo 518: El término "Libre de gluten" y el logo o símbolo de la espiga tachada, solo podrán utilizarse cuando el resultado del análisis de laboratorio del producto alimenticio no sobrepase 3 mg/kg de gluten de los cereales establecidos en el artículo 516, del producto listo para su entrega al consumidor final, de acuerdo a las técnicas analíticas que, para estos efectos, determine el Instituto de Salud Pública de Chile. La expresión "Libre de gluten" se rotulará en las proximidades del nombre del producto, con caracteres de buen realce, tamaño y visibilidad.
Art. 1 N° 2
D.O. 14.01.2015 Artículo 518: El término "Libre de gluten" y el logo o símbolo de la espiga tachada, solo podrán utilizarse cuando el resultado del análisis de laboratorio del producto alimenticio no sobrepase 3 mg/kg de gluten de los cereales establecidos en el artículo 516, del producto listo para su entrega al consumidor final, de acuerdo a las técnicas analíticas que, para estos efectos, determine el Instituto de Salud Pública de Chile. La expresión "Libre de gluten" se rotulará en las proximidades del nombre del producto, con caracteres de buen realce, tamaño y visibilidad.
Artículo 519.- Se entiende por alimentos paraDTO 475, SALUD
Art. Unico, N° 151
D.O. 13.01.2000 regímenes de control de peso, aquellos que según las instrucciones correspondientes sustituyen la totalidad de la dieta o una parte de la misma.
Art. Unico, N° 151
D.O. 13.01.2000 regímenes de control de peso, aquellos que según las instrucciones correspondientes sustituyen la totalidad de la dieta o una parte de la misma.
En el rótulo junto al nombre principal del alimento,DTO 115, SALUD
Art. primero Nº 25
D.O. 25.11.2003 formando parte del mismo o junto a la información nutricional deberá señalarse, con caracteres fáciles de leer en circunstancias normales de compra y uso la frase "alimento para control de peso".
Art. primero Nº 25
D.O. 25.11.2003 formando parte del mismo o junto a la información nutricional deberá señalarse, con caracteres fáciles de leer en circunstancias normales de compra y uso la frase "alimento para control de peso".
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 520.- Un producto que se presente comoDTO 475, SALUD
Art. Unico, N° 1
D.O. 13.01.2000 sustituto de todas las comidas de la dieta diaria deberá aportar como mínimo 800 kcal. y como máximo 1.200 kcal.
Art. Unico, N° 1
D.O. 13.01.2000 sustituto de todas las comidas de la dieta diaria deberá aportar como mínimo 800 kcal. y como máximo 1.200 kcal.
Cuando el producto total se presente dividido en porciones, 3 o 4 diarias, según los hábitos alimenticios de la persona, estas porciones deberán suministrar aproximadamente una tercera o una cuarta parte del aporte energético total del producto, respectivamente.
Artículo 521.- Si el producto se presenta comoDTO 475, SALUD
Art. Unico, N° 1
D.O. 13.01.2000 sustituto de una o más comidas de la dieta diaria deberá aportar como mínimo 200 kcal y como máximo 400 kcal. por comida, esto referido al producto tal como se comercialDecreto 24, SALUD
Art. 1 Nº 11
D.O. 24.11.2011iza.
Art. Unico, N° 1
D.O. 13.01.2000 sustituto de una o más comidas de la dieta diaria deberá aportar como mínimo 200 kcal y como máximo 400 kcal. por comida, esto referido al producto tal como se comercialDecreto 24, SALUD
Art. 1 Nº 11
D.O. 24.11.2011iza.
Artículo 522.- Los sustitutos de comidas para regímenes de control de peso se prepararán con elementos constituyentes de proteínas de origen animal y vegetal que se hayan demostrado aptos para el consumo humano, y con otros ingredientes apropiados para obtener la composición esencial del producto.
Artículo 523.- El contenido de proteínas de estos productos será de un 25% como mínimo y un 50% como máximo de la energía disponible del alimento listo para su consumo.
La ingesta total diaria de proteínas no será superior a 125 g. La calidad biológica de las proteínas no será menor a un 80% de las proteínas del huevo o de la leche. Para mejorar la calidad de las proteínas podrán añadirse aminoácidos esenciales pero sólo en las cantidades necesarias para tal efecto. Los aminoácidos utilizados deberán presentarse en su forma levógira, pero se podrá utilizar DL-metionina.
Artículo 524.- Estos Decreto 24, SALUD
Art. 1 Nº 12
D.O. 24.11.2011alimentos deberán cumplir con el descriptor bajo en grasa y no deberán aportar, en forma de grasa total, más del 30% de la energía disponible en el alimento. No menos del 3% de la energía disponible deberá ser aportada como ácido linoleico.
Art. 1 Nº 12
D.O. 24.11.2011alimentos deberán cumplir con el descriptor bajo en grasa y no deberán aportar, en forma de grasa total, más del 30% de la energía disponible en el alimento. No menos del 3% de la energía disponible deberá ser aportada como ácido linoleico.
Artículo 525.- Cuando unDecreto 24, SALUD
Art. 1 Nº 13
D.O. 24.11.2011 alimento se presente como sustitutivo de todas las comidas de un día, deberá contener, al menos, el 100% de las cantidades de vitaminas y minerales especificadas a continuación, en el producto tal como se comercializa:
Art. 1 Nº 13
D.O. 24.11.2011 alimento se presente como sustitutivo de todas las comidas de un día, deberá contener, al menos, el 100% de las cantidades de vitaminas y minerales especificadas a continuación, en el producto tal como se comercializa:
Vitamina A 600 mcg EAR
Vitamina D 2,5 mcg D 3
Vitamina E 10 mg ET
Vitamina C 60 mg
Tiamina 0,8 mg
Riboflavina 1,2 mg
Niacina 11 mg
Vitamina B 6 2 mg
Vitamina B 12 1 mcg
Folato 200 mcg EFA
Calcio 500 mg
Fósforo 500 mg
Hierro 14 mg
Yodo 140 mcg
Magnesio 300 mg
Cobre 1,5 mg
Zinc 6 mg
Potasio 1,6 g
Sodio 0,6 g
Estos alimentos que se presenten como sustitutivo de todas las comidas de un día deberán contener un mínimo de 13 g de fibra dietética total. Las cantidades por cada tiempo de comida, deberán ajustarse a una cantidad que corresponda al 33% o 25% del total señalado, según si el número de porciones recomendadas por día es de 3 o 4, respectivamente, lo que corresponde a 4,3 g o 3,3 g de fibra dietética/porción, según si son 3 o 4 porciones por día.
Se podrán incluir otros nutrientes esenciales no especificados en esta lista para los que exista Dosis Diaria Remendada o Valores de Referencia Diaria, la sumatoria o concentración final de ellos en el producto, no deberá ser superior al 100% de la Dosis Diaria de Referencia establecida para el nutriente en particular.
Decreto 106, SALUD
Art. 1 Nº 51
D.O. 23.04.2009 Artículo 526.- Cuando un producto se presente como sustituto de una sola comida de la dieta diaria, es decir como reemplazo de una de las principales comidas del día, desayuno, almuerzo, once o cena, las cantidades de vitaminas y minerales deberán ajustarse a una cifra que corresponda al 33% ó 25% del total señalado en el artículo anterior, según si el número de porciones recomendadas por día es de 3 o 4, respectivamente.
Art. 1 Nº 51
D.O. 23.04.2009 Artículo 526.- Cuando un producto se presente como sustituto de una sola comida de la dieta diaria, es decir como reemplazo de una de las principales comidas del día, desayuno, almuerzo, once o cena, las cantidades de vitaminas y minerales deberán ajustarse a una cifra que corresponda al 33% ó 25% del total señalado en el artículo anterior, según si el número de porciones recomendadas por día es de 3 o 4, respectivamente.
Artículo 527.- Estos productos se etiquetaránDTO 475, SALUD
Art. Unico, N° 154
D.O. 13.01.2000 conforme las disposiciones relativas a etiquetado general y según lo dispuesto en el artículo 491. Si en las instrucciones para el uso se indica que el producto debe combinarse con otros ingredientes, en la etiqueta deberá agregarse la declaración del valor nutritivo por porción de consumo habitual del resultado final de la combinación.
Art. Unico, N° 154
D.O. 13.01.2000 conforme las disposiciones relativas a etiquetado general y según lo dispuesto en el artículo 491. Si en las instrucciones para el uso se indica que el producto debe combinarse con otros ingredientes, en la etiqueta deberá agregarse la declaración del valor nutritivo por porción de consumo habitual del resultado final de la combinación.
En lo particular, en la etiqueta o etiquetado no se deberá hacer referencia al ritmo ni a la magnitud de la pérdida de peso resultante del consumo del alimento, como tampoco a la disminución de la sensación de hambre ni al aumento de la sensación de saciedad.
Artículo 528.- En la etiqueta o en el etiquetado deberá hacerse referencia a la necesidad de mantener una ingesta adecuada de líquido cuando se utilizan preparados para el control de peso. Si el consumo de alimentos proporciona una ingestaDTO 475, SALUD
Art. Unico, N° 155
D.O. 13.01.2000 diaria de alcoholes de azúcar superior a los 20 g diarios, la etiqueta deberá llevar una declaración de que el alimento podría tener un efecto laxante. La etiqueta deberá llevar una declaración de que el alimento puede ser útil para el control de peso únicamente como parte de una dieta con un contenido energético controlado. La etiqueta de los productos que se presentan como sustitutos de la dieta total para utilizar durante más de seis semanas, deberá contener una recomendación de que transcurrido ese período deberá solicitarse asesoría médica.
Art. Unico, N° 155
D.O. 13.01.2000 diaria de alcoholes de azúcar superior a los 20 g diarios, la etiqueta deberá llevar una declaración de que el alimento podría tener un efecto laxante. La etiqueta deberá llevar una declaración de que el alimento puede ser útil para el control de peso únicamente como parte de una dieta con un contenido energético controlado. La etiqueta de los productos que se presentan como sustitutos de la dieta total para utilizar durante más de seis semanas, deberá contener una recomendación de que transcurrido ese período deberá solicitarse asesoría médica.
Decreto 24, SALUD
Art. 1 Nº 14
D.O. 24.11.2011 Párrafo VIII De los alimentos con bajo contenido de grasas y/o calorías.- DEROGADO
Art. 1 Nº 14
D.O. 24.11.2011 Párrafo VIII De los alimentos con bajo contenido de grasas y/o calorías.- DEROGADO
TÍTULO XXIX
DE LOS SUPLEMENTOS ALIMENTARIOS Y DE LOS ALIMENTOS
DTO 253, SALUD
Nº 1 A) y B)
D.O. 20.01.2003PARA DEPORTISTAS
Nº 1 A) y B)
D.O. 20.01.2003PARA DEPORTISTAS
Artículo 534.- Suplementos alimentarios son aquellos productos elaborados o preparados especialmente para suplementar la dieta con fines saludables y contribuir a mantener o proteger estados fisiológicos característicos tales como adolescencia, adultez o vejez.
Su composición podrá corresponder a un nutriente, mezcla de nutrientes y otros componentes presentes naturalmente en los alimentos, incluyendo compuestos tales como vitaminas, minerales, aminoácidos, lípidos, fibra dietética o sus fracciones.
Se podrán expender en diferentes formas de liberación convencional, tales como polvos, líquidos, granulados, grageas, comprimidos, tabletas, cápsulas u otras propias de los medicamentos.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
Artículo 535.- Los ingredientes dietarios paraDTO 287, SALUD
Art. 2º
D.O. 18.02.2002 suplementos alimentarios, que son las substancias utilizadas intencionalmente para suplementar la dieta humana, incrementando la ingesta diaria total de vitaminas, minerales, aminoácidos, lípidos, fibra dietética u otros elementos naturalmente presentes en los alimentos, deberán cumplir con la identidad y pureza indicada en las especificaciones de calidad e inocuidad.
Art. 2º
D.O. 18.02.2002 suplementos alimentarios, que son las substancias utilizadas intencionalmente para suplementar la dieta humana, incrementando la ingesta diaria total de vitaminas, minerales, aminoácidos, lípidos, fibra dietética u otros elementos naturalmente presentes en los alimentos, deberán cumplir con la identidad y pureza indicada en las especificaciones de calidad e inocuidad.
Artículo 536.- La declaración de propiedadesDTO 287, SALUD
Art. 2º
D.O. 18.02.2002 saludables y nutricionales, y la información nutricional complementaria que se describa en los envases de estos productos, deberá ceñirse a las normas establecidas para estos fines en este reglamento, siendo prohibidoDTO 57, SALUD
Art. único Nº 13
D.O. 06.05.2005 promocionar su consumo para fines de diagnóstico, prevención o tratamiento de las enfermedades.
Art. 2º
D.O. 18.02.2002 saludables y nutricionales, y la información nutricional complementaria que se describa en los envases de estos productos, deberá ceñirse a las normas establecidas para estos fines en este reglamento, siendo prohibidoDTO 57, SALUD
Art. único Nº 13
D.O. 06.05.2005 promocionar su consumo para fines de diagnóstico, prevención o tratamiento de las enfermedades.
NOTA:
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
Artículo 537.- La publicidad, a través de cualquierDTO 287, SALUD
Art. 2º
D.O. 18.02.2002 medio, así como la rotulación de los suplementos alimentarios, deberá adecuarse a las normas que sobre el particular se contemplan en este reglamento;
Art. 2º
D.O. 18.02.2002 medio, así como la rotulación de los suplementos alimentarios, deberá adecuarse a las normas que sobre el particular se contemplan en este reglamento;
adicionalmente, estos productos deberán señalar en su etiquetado, en forma destacada en la cara principal del envase y a continuación del nombre del producto, su clasificación de "suplemento alimentario".
Todos los suplementos alimentarios deberán incluir, inmediatamente por debajo de la rotulación como "Suplemento Alimentario", una leyenda que señale: "Su uso no es recomendable para consumo por menores de 8 años, embarazadas y nodrizas, salvo indicación profesional competente y no reemplaza a una alimentación balanceada".
Artículo 538.- Los niveles, máximo y mínimo, deDTO 287, SALUD
Art. 2º
D.O. 18.02.2002 vitaminas, minerales y demás componentes a que alude el artículo 534, serán establecidos por resolución del Ministerio de Salud, dictada en uso de sus atribuciones legales técnico normativas.
Art. 2º
D.O. 18.02.2002 vitaminas, minerales y demás componentes a que alude el artículo 534, serán establecidos por resolución del Ministerio de Salud, dictada en uso de sus atribuciones legales técnico normativas.
Artículo 539.- Alimentos para deportistas son aquellos productos alimentarios formulados para satisfacer requerimientos de individuos sanos, en especial de aquellos que realicen ejercicios físicos pesados y prolongados.
Estos alimentos estarán compuestos por un ingrediente alimentario o mezcla de éstos. Se les podrá adicionar uno o más nutrientes, como hidratos de carbono, proteínas, vitaminas, minerales y otros componentes presentes naturalmente en los alimentos, tales como cafeína o aquellos expresamente autorizados en el presente Reglamento. En su elaboración se deberán cumplir las normas de las buenas prácticas de manufactura.
En ellos no se podrá incorporar, solos ni en asociación, hormonas o compuestos con efecto anabolizante. Tampoco se les podrá incorporar sustancias con acción estimulante sobre el sistema nervioso, salvo aquellas que estén expresamente autorizadas y dentro de los límites permitidos para este tipo de alimentos en este Reglamento.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
Artículo 540.- Sólo podrán considerarse alimentos para deportistas aquellos que cumplan con los requisitos de alguna de las propiedades nutricionales que se indican a continuación. Ellos deberán colocar en la DTO 253, SALUD
Nº 1 D)
D.O. 20.01.2003etiqueta, en el panel principal del envase, con letras fácilmente legibles en color contrastante con el fondo de la etiqueta: "ALIMENTO PARA DEPORTISTAS ......." con el descriptor que se indica entre comillas, según corresponda:
Nº 1 D)
D.O. 20.01.2003etiqueta, en el panel principal del envase, con letras fácilmente legibles en color contrastante con el fondo de la etiqueta: "ALIMENTO PARA DEPORTISTAS ......." con el descriptor que se indica entre comillas, según corresponda:
a) "Alto en energía". Aquellos alimentos que tienen por porción de consumo habitual un 30%, o más, de la dosis diaria de referencia (DDR) de energía (DDR = 20Decreto 24, SALUD
Art. 1 Nº 15
D.O. 24.11.201100 Kcal/día).
Art. 1 Nº 15
D.O. 24.11.201100 Kcal/día).
b) "Buena fuente de energía". Alimentos que tienen por porción de consumo habitual entre un 20% y un 29% de la dosis diaria de referencia de energía.
c) "Alto en hidratos de carbono disponibles".
Alimentos que tienen por porción de consumo habitual un 30%, o más, de la dosis diaria de referencia de carbohidratos disponibles (DDR = 350 g de carbohidratos disponibles/día).
d) "Buena fuente de hidratos de carbono disponibles".
Alimentos que tienen por porción de consumo habitual entre un 20% y un 29% de la dosis diaria de referencia de carbohidratos disponibles.
e) "Alto en proteínas". Alimentos que tienen por porción de consumo habitual de referencia un 40%, o más, de la dosis diaria de referencia de proteínas equivalente a una óptima calidad y digestibilidad (DDR = 50 g de proteínas).
f) "Buena fuente de proteínas". Alimentos que tienen por porción de consumo habitual entre un 20% y un 39% de la DDR de proteínas equivalente a una óptima calidad y digestibilidad.
g) "Con adición de aminoácidos". A estos alimentos se les podrá adicionar los aminoácidos que a continuación se indican, hasta las cantidades máximas por día que se señalan. En la recomendación de consumo de la etiqueta no se podrá sobrepasar las cantidades máximas por día que se indican en cada caso.
Aminoácido Cantidad máxima por día
mg
Alanina 4800
Arginina 4400
Acido aspártico 2400
Cisteína 1800
Glutamina 5600
Acido glutámico 6400
Glicina 6000
Histidina 1700
Isoleucina 1400
Leucina 1900
Lisina 1700
Metionina 720
Ornitina 1400
Fenilalanina 1900
Prolina 4400
Serina 5600
Taurina 1500
Treonina 1000
Tirosina 1600
Triptofano 100
Valina 1400
Los alimentos que tengan fenilalanina deberán incluir en la etiqueta el siguiente mensaje:
"Fenilcetonúricos: contiene fenilalanina". Los alimentos cuyo contenido de taurina sea igual o superior a 500 mg por porción de consumo deberán incluir en la etiqueta el siguiente mensaje: "No recomendable para diabéticos".
h) "Con adición de electrolitos". Los aliDTO 68, SALUD
Art. primero Nº 34
D.O. 23.01.2006mentos que se presentan como bebidas no alcohólicas o preparaciones a reconstituir podrán contener electrolitos como sodio y/o potasio. El contenido de sodio deberá ser igual o mayor a 10 mmol/l (230 mg Na+/l), el contenido de potasio deberá ser igual o mayor a 2 mmol/l (78 mg K+/l). Estas bebidas podrán ser isotónicas o hipotónicas y deberán ser formuladas para tener una osmolalidad mínima de 200 mosm/kg de agua y máxima de 340 mosm/kg de agua. Las bebidas que presenten una osmolalidad entre 200 y 250 mosm/kg de agua podrán denominarse: "hipotónicas" y aquellas que presenten una osmolalidad entre 250 y 340 mosm/kg de agua, podrán denominarse: "isotónicas".
Art. primero Nº 34
D.O. 23.01.2006mentos que se presentan como bebidas no alcohólicas o preparaciones a reconstituir podrán contener electrolitos como sodio y/o potasio. El contenido de sodio deberá ser igual o mayor a 10 mmol/l (230 mg Na+/l), el contenido de potasio deberá ser igual o mayor a 2 mmol/l (78 mg K+/l). Estas bebidas podrán ser isotónicas o hipotónicas y deberán ser formuladas para tener una osmolalidad mínima de 200 mosm/kg de agua y máxima de 340 mosm/kg de agua. Las bebidas que presenten una osmolalidad entre 200 y 250 mosm/kg de agua podrán denominarse: "hipotónicas" y aquellas que presenten una osmolalidad entre 250 y 340 mosm/kg de agua, podrán denominarse: "isotónicas".
La recomendación de consumo de los "Alimentos para Deportistas" que se rotule, adjunte o relacione con el producto no podrá sobrepasar, por día, las cantidades de sodio y potasio, que se indican a continuación:
Electrolito Cantidad máxima por día
mmol mg
Sodio 70 1610
Potasio 95 3715
i) "Con adición de vitaminas y/o minerales". Si se adicionan vitaminas y/o minerales, estos productos alimenticios deberán clasificarse según corresponda como "Alimento Fortificado" o "Suplemento Alimentario", respetando los límites establecidos para cada nutriente en cada categoría.
Cuando un "Alimento para Deportistas" califique además como "Suplemento Alimentario" deberá dar cumplimiento a los artículos correspondientes de este Reglamento, especialmente, pero no sólo, a lo establecido en el Párrafo I del Título XXIX.
j) Con cafeína. La cafeína podrá ser incorporada en forma pura o por adición de uno o más ingredientes alimentarios que la contengan. De los cuales sólo se podrán utilizar los siguientes ingredientes:
café (Coffea spp.), té verde o té negro (Camellia sinensis o Thea sinensis), cacao (Theobroma cacao), yerba mate (Ilex brasillensis e Ilex paraguariensis), nuez de cola (Kola spp.) y guaraná (Paullinia cupana), como tales o en forma de extractos. La recomendación de consumo en la etiqueta y/o publicidad no podrá sobrepasar los 500 mg. de cafeína por día.
k) Con adición de otros compuestos. A los alimentos para deportistas se les podrá incorporar los ingredientes alimentarios que a continuación se indican pudiendo contener las cantidades máximas por porción de consumo habitual que se establecen.
La recomendación de consumo que se rotule, adjunte o relacione con el producto no podrá sobrepasar, por día, las cantidades máximas que se indican en cada caso. En estos alimentos se deberá usar el descritpor: "Con ................", indicando el nombre del ingrediente, según corresponda, así por ejemplo si tiene adición de L-carnitina y colina, se deberá utilizar el descriptor: "Con L-carnitina y colina"
Ingrediente alimentario Cantidad máxima
por día
L - carnitina 2 g
Inosina 10 mg
Ubiquinona 15 mg
Creatina 5 g
Delta-gluconolactona o 600 mg
Glucono-delta-lactona
l) Con hierbas: Se podrá incorporar como ingredientes alimentarios las hierbas, y/o extractos de las hierbas que a continuación se indican, en las cantidades máximas por porción de consumo habitual que se establecen. La recomendación de consumo de los "Alimentos para Deportistas" que se rotule, adjunte o relacione con el producto no podrá sobrepasar las cantidades máximas por día que se indican en cada caso.
Ingrediente alimentario Cantidad máxima
por día
Raíz de Panax Ginseng C.A. Meyer
(Ginseng Coreano, Ginseng
Asiático o Ginseng Oriental)
1,0 g de raíz
Fruto de Schizandra Chinesis
(Turcz.)
Baill. (Chisandra) 1,5 g de fruto
Raíz y risoma de Eleuterococcus
Senticosus Rupr. et Maxim.
(Ginseng Siberiano) 2,0 g de raíz y
rizoma
Si estos ingredientes se incorporan en forma de extractos, éstos deberán ser apropiados para uso en alimentos y su concentración máxima deberá ser calculada considerando la equivalencia del contenido especificado en cada una de las formas incluidas en esta tabla.
En los alimentos que contengan una o más de estas hierbas, el contenido máximo de cafeína en el producto listo para el consumo será de 54 mg. por porción de consumo habitual y no más de 180 mg. de cafeína/litro en los alimentos que se consumen líquidos y de 90 mg/100 g. en los que se consumen sólidos.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
NOTA 1:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 541.- Los alimentos para deportistasDTO 253, SALUD
Nº 1 D)
D.O. 20.01.2003 se etiquetarán conforme a las disposiciones relativas a etiquetado general y según lo dispuesto en los artículos 110 y 540 de este Reglamento.
Nº 1 D)
D.O. 20.01.2003 se etiquetarán conforme a las disposiciones relativas a etiquetado general y según lo dispuesto en los artículos 110 y 540 de este Reglamento.
Los que tengan adición de: aminoácidos, L- carnitina, colina, inosina, ubiquinona, creatina, hierbas o extractos de Panax ginseng C.A. Meyer, Schizandra chinesis (Turcz.) Baill., Eleuterococcus senticosus Rupr. et Maxim, o que su contenido de cafeína sea mayor a 180 mg/l. en los alimentos líquidos y en los sólidos mayor a 90 mg/100 g., deberán incluir una leyenda que diga: "NO RECOMENDABLE PARA MENORES DE 15 AÑOS, EN EMBARAZO NI LACTANCIA" en letras mayúsculas y negrita (destacado).
INCISO DEROGADODTO 57, SALUD
Art. único Nº 14
D.O. 06.05.2005
Art. único Nº 14
D.O. 06.05.2005
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
NOTA 1:
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
Artículo 542.- Las infracciones a las disposicionesDTO 253, SALUD
Nº 1 C)
D.O. 20.01.2003 del presente reglamento serán sancionadas por los Servicios de Salud en cuyo territorio se hayan cometido, previa instrucción del respectivo sumario, en conformidad con lo establecido en el Libro X del Código Sanitario.
Nº 1 C)
D.O. 20.01.2003 del presente reglamento serán sancionadas por los Servicios de Salud en cuyo territorio se hayan cometido, previa instrucción del respectivo sumario, en conformidad con lo establecido en el Libro X del Código Sanitario.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la modificación introducida al presente artículo entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la modificación introducida al presente artículo entrará en vigencia 30 días después de su publicación en el Diario Oficial.
Artículo 543.- El presente reglamento entrará enDTO 253, SALUD
Nº 1 C)
D.O. 20.01.2003 vigencia ciento ochenta días después de su publicación en el Diario Oficial, fecha en que se entenderán derogados el decreto supremo N° 60, del 5 de abril de 1982, del Ministerio de Salud y sus modificaciones, así como cualquier otra norma, resolución o disposición que fuera contraria o incompatible con las contenidas en este decreto supremo.
Nº 1 C)
D.O. 20.01.2003 vigencia ciento ochenta días después de su publicación en el Diario Oficial, fecha en que se entenderán derogados el decreto supremo N° 60, del 5 de abril de 1982, del Ministerio de Salud y sus modificaciones, así como cualquier otra norma, resolución o disposición que fuera contraria o incompatible con las contenidas en este decreto supremo.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la modificación introducida al presente artículo entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la modificación introducida al presente artículo entrará en vigencia 30 días después de su publicación en el Diario Oficial.
Artículo Transitorio.- Sin perjuicio de lo dispuesto en el artículo anterior, la autoridad sanitaria podrá, por resolución fundada, autorizar la comercialización de productos alimenticios que no cumplan con las disposiciones de este reglamento, por un plazo máximo de un año, contado desde la fecha de su publicación.
Anótese, tómese razón, publíquese en el Diario Oficial e insértese en la Recopilación de Reglamentos de la Contraloría General de República.- EDUARDO FREI RUIZ-TAGLE, Presidente de la República.- Carlos Massad A., Ministro de Salud.
Lo que transcribo a Ud., para su conocimiento.- Saluda atentamente a Ud., Fernando Muñoz Porras, Subsecretario de Salud.
| Tipo Versión | Desde | Hasta | Modificaciones | |
|---|---|---|---|---|
|
Con Vigencia Diferida por Fecha
De 19-JUN-2026
|
19-JUN-2026 |
|
||
|
Con Vigencia Diferida por Fecha
De 17-ABR-2026
|
17-ABR-2026 | 18-JUN-2026 | ||
|
Con Vigencia Diferida por Fecha
De 15-JUL-2025
|
15-JUL-2025 | 16-ABR-2026 | ||
|
Última Versión
De 23-OCT-2024
|
23-OCT-2024 | 14-JUL-2025 | ||
|
Intermedio
De 06-JUL-2024
|
06-JUL-2024 | 22-OCT-2024 | ||
|
Intermedio
De 12-MAY-2024
|
12-MAY-2024 | 05-JUL-2024 | ||
|
Intermedio
De 27-ENE-2024
|
27-ENE-2024 | 11-MAY-2024 | ||
|
Intermedio
De 26-DIC-2023
|
26-DIC-2023 | 26-ENE-2024 | ||
|
Intermedio
De 03-AGO-2021
|
03-AGO-2021 | 25-DIC-2023 | ||
|
Intermedio
De 13-MAY-2020
|
13-MAY-2020 | 02-AGO-2021 | ||
|
Intermedio
De 07-MAR-2020
|
07-MAR-2020 | 12-MAY-2020 | ||
|
Intermedio
De 04-ENE-2020
|
04-ENE-2020 | 06-MAR-2020 | ||
|
Intermedio
De 14-ENE-2019
|
14-ENE-2019 | 03-ENE-2020 | ||
|
Intermedio
De 08-ENE-2019
|
08-ENE-2019 | 13-ENE-2019 | ||
|
Intermedio
De 14-DIC-2018
|
14-DIC-2018 | 07-ENE-2019 | ||
|
Intermedio
De 25-OCT-2018
|
25-OCT-2018 | 13-DIC-2018 | ||
|
Intermedio
De 29-MAY-2018
|
29-MAY-2018 | 24-OCT-2018 | ||
|
Intermedio
De 03-FEB-2018
|
03-FEB-2018 | 28-MAY-2018 | ||
|
Intermedio
De 29-ENE-2018
|
29-ENE-2018 | 02-FEB-2018 | ||
|
Intermedio
De 18-ENE-2017
|
18-ENE-2017 | 28-ENE-2018 | ||
|
Intermedio
De 28-NOV-2016
|
28-NOV-2016 | 17-ENE-2017 | ||
|
Intermedio
De 12-OCT-2016
|
12-OCT-2016 | 27-NOV-2016 | ||
|
Intermedio
De 03-OCT-2016
|
03-OCT-2016 | 11-OCT-2016 | ||
|
Intermedio
De 30-AGO-2016
|
30-AGO-2016 | 02-OCT-2016 | ||
|
Intermedio
De 27-JUN-2016
|
27-JUN-2016 | 29-AGO-2016 | ||
|
Intermedio
De 06-JUN-2016
|
06-JUN-2016 | 26-JUN-2016 | ||
|
Intermedio
De 13-JUL-2015
|
13-JUL-2015 | 05-JUN-2016 | ||
|
Intermedio
De 21-MAY-2015
|
21-MAY-2015 | 12-JUL-2015 | ||
|
Intermedio
De 27-ENE-2015
|
27-ENE-2015 | 20-MAY-2015 |
|
|
|
Intermedio
De 07-OCT-2014
|
07-OCT-2014 | 26-ENE-2015 | ||
|
Intermedio
De 17-SEP-2014
|
17-SEP-2014 | 06-OCT-2014 | ||
|
Intermedio
De 30-MAY-2014
|
30-MAY-2014 | 16-SEP-2014 | ||
|
Intermedio
De 05-ENE-2014
|
05-ENE-2014 | 29-MAY-2014 | ||
|
Intermedio
De 19-NOV-2013
|
19-NOV-2013 | 04-ENE-2014 | ||
|
Intermedio
De 18-OCT-2013
|
18-OCT-2013 | 18-NOV-2013 | ||
|
Intermedio
De 05-OCT-2013
|
05-OCT-2013 | 17-OCT-2013 | ||
|
Intermedio
De 06-AGO-2013
|
06-AGO-2013 | 04-OCT-2013 | ||
|
Intermedio
De 08-JUL-2013
|
08-JUL-2013 | 05-AGO-2013 | ||
|
Intermedio
De 19-ABR-2013
|
19-ABR-2013 | 07-JUL-2013 | ||
|
Intermedio
De 06-ENE-2013
|
06-ENE-2013 | 18-ABR-2013 |
|
|
|
Intermedio
De 25-NOV-2012
|
25-NOV-2012 | 05-ENE-2013 |
|
|
|
Intermedio
De 23-AGO-2012
|
23-AGO-2012 | 24-NOV-2012 | ||
|
Intermedio
De 01-ABR-2012
|
01-ABR-2012 | 22-AGO-2012 | ||
|
Intermedio
De 29-ENE-2012
|
29-ENE-2012 | 31-MAR-2012 | ||
|
Intermedio
De 29-OCT-2011
|
29-OCT-2011 | 28-ENE-2012 |
|
|
|
Intermedio
De 26-DIC-2010
|
26-DIC-2010 | 28-OCT-2011 | ||
|
Intermedio
De 11-MAR-2010
|
11-MAR-2010 | 25-DIC-2010 |
|
|
|
Intermedio
De 11-DIC-2009
|
11-DIC-2009 | 10-MAR-2010 | ||
|
Intermedio
De 24-OCT-2009
|
24-OCT-2009 | 10-DIC-2009 | ||
|
Intermedio
De 23-OCT-2009
|
23-OCT-2009 | 23-OCT-2009 | ||
|
Intermedio
De 06-MAY-2008
|
06-MAY-2008 | 22-OCT-2009 |
|
|
|
Intermedio
De 12-JUL-2007
|
12-JUL-2007 | 05-MAY-2008 |
|
|
|
Intermedio
De 16-JUN-2007
|
16-JUN-2007 | 11-JUL-2007 |
|
|
|
Intermedio
De 06-NOV-2006
|
06-NOV-2006 | 15-JUN-2007 | ||
|
Intermedio
De 04-AGO-2006
|
04-AGO-2006 | 05-NOV-2006 |
|
|
|
Intermedio
De 03-AGO-2006
|
03-AGO-2006 | 03-AGO-2006 |
|
|
|
Intermedio
De 23-JUL-2006
|
23-JUL-2006 | 02-AGO-2006 | ||
|
Intermedio
De 22-JUL-2006
|
22-JUL-2006 | 22-JUL-2006 |
|
|
|
Intermedio
De 12-JUL-2006
|
12-JUL-2006 | 21-JUL-2006 | ||
|
Intermedio
De 04-FEB-2006
|
04-FEB-2006 | 11-JUL-2006 | ||
|
Intermedio
De 05-NOV-2004
|
05-NOV-2004 | 03-FEB-2006 | ||
|
Intermedio
De 25-MAY-2004
|
25-MAY-2004 | 04-NOV-2004 |
|
|
|
Intermedio
De 05-MAY-2004
|
05-MAY-2004 | 24-MAY-2004 |
|
|
|
Intermedio
De 24-JUL-2003
|
24-JUL-2003 | 04-MAY-2004 | ||
|
Intermedio
De 24-JUN-2003
|
24-JUN-2003 | 23-JUL-2003 | ||
|
Intermedio
De 20-FEB-2003
|
20-FEB-2003 | 23-JUN-2003 | ||
|
Intermedio
De 18-FEB-2002
|
18-FEB-2002 | 19-FEB-2003 |
|
|
|
Intermedio
De 26-MAY-2000
|
26-MAY-2000 | 17-FEB-2002 | ||
|
Intermedio
De 28-ABR-2000
|
28-ABR-2000 | 25-MAY-2000 | ||
|
Intermedio
De 09-MAR-2000
|
09-MAR-2000 | 27-ABR-2000 | ||
|
Intermedio
De 08-FEB-2000
|
08-FEB-2000 | 08-MAR-2000 | ||
|
Intermedio
De 13-ENE-2000
|
13-ENE-2000 | 07-FEB-2000 | ||
|
Intermedio
De 31-JUL-1999
|
31-JUL-1999 | 12-ENE-2000 | ||
|
Intermedio
De 03-FEB-1998
|
03-FEB-1998 | 30-JUL-1999 | ||
|
Texto Original
De 13-MAY-1997
|
13-MAY-1997 | 02-FEB-1998 |
Comparando Decreto 977 |
Loading...