Decreto 123 EXENTO
Navegar Norma
Decreto 123 EXENTO
Decreto 123 EXENTO MODIFICA DECRETO Nº500 EXENTO, DE 2012, QUE APROBÓ NORMA TÉCNICA Nº 136, NOMINADA "NORMA QUE DETERMINA LOS PRINCIPIOS ACTIVOS CONTENIDOS EN PRODUCTOS FARMACÉUTICOS QUE DEBEN DEMOSTRAR SU EQUIVALENCIA TERAPÉUTICA Y LISTA DE PRODUCTOS FARMACÉUTICOS QUE SIRVEN DE REFERENCIA DE LOS MISMOS"
MINISTERIO DE SALUD; SUBSECRETARÍA DE SALUD PÚBLICA
Promulgación: 24-FEB-2014
Publicación: 13-MAR-2014
Versión: Última Versión - 16-DIC-2015
MODIFICA DECRETO Nº500 EXENTO, DE 2012, QUE APROBÓ NORMA TÉCNICA Nº 136, NOMINADA "NORMA QUE DETERMINA LOS PRINCIPIOS ACTIVOS CONTENIDOS EN PRODUCTOS FARMACÉUTICOS QUE DEBEN DEMOSTRAR SU EQUIVALENCIA TERAPÉUTICA Y LISTA DE PRODUCTOS FARMACÉUTICOS QUE SIRVEN DE REFERENCIA DE LOS MISMOS"
Núm. 123 exento.- Santiago, 24 de febrero de 2014.- Visto: Lo dispuesto en el artículo 4º del Libro I del decreto con fuerza de ley Nº 1 de 2005, del Ministerio de Salud, que fija el texto refundido, coordinado y sistematizado del decreto ley 2.763, de 1979 y de las leyes 18.469 y 18.933; la ley Nº 20.724; las disposiciones del artículo 52º y aquellas del inciso 1º del artículo 221º, contenidas en el decreto supremo Nº 3, de 2010, también del Ministerio de Salud y mediante el cual se aprueba el Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano; lo solicitado por el Instituto de Salud Pública de Chile, mediante los oficios ordinarios Nº 349 y Nº 350, ambos de fecha 6 de febrero de 2014, que comunican propuesta de listado de principios activos contenidos en formas farmacéuticas sólidas que deben demostrar equivalencia terapéutica en Chile, así como listado de referentes de dichos principios activos y de otros ya contenidos en el decreto exento Nº 500, de fecha 1 de junio de 2012, y teniendo presente las facultades concedidas en el decreto supremo Nº 28, de 2009 del Ministerio de Salud, dicto el siguiente,
Decreto:
Artículo primero.- Modifícase el decreto exento Nº 500, de fecha 1 de junio de 2012, del Ministerio de Salud, publicado en el Diario Oficial de 6 de junio de 2012, mediante el cual se aprobó la Norma Técnica Nº 136, nominada "Norma que Determina los Principios Activos Contenidos en Productos Farmacéuticos que deben Demostrar su Equivalencia Terapéutica y Lista de Productos Farmacéuticos que Sirven de Referencia de los Mismos" en la forma que a continuación se indica:
a) Incorpórense a la "Lista de principios activos contenidos en productos farmacéuticos que deberán realizar estudios comparativos de biodisponibilidad in vivo para demostrar equivalencia terapéutica" los siguientes:
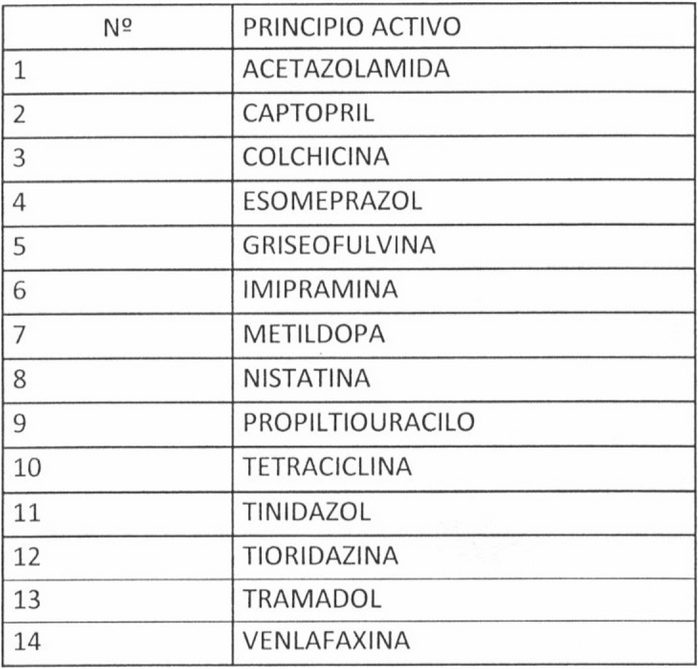
b) Incorpórense a la "Lista de productos de referencia para los estudios de equivalencia terapéutica", los siguientes:
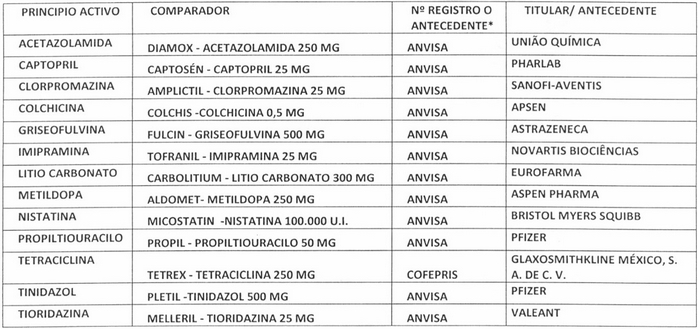
* = Producto designado como referente para estudios de Equivalencia Terapéutica, por la autoridad reguladora que se indica.
c) Incorpórense a continuación de la "Lista de productos de referencia para los estudios de equivalencia terapéutica", lo siguiente:
LISTA DE PRODUCTOS DE REFERENCIA PARA LOS ESTUDIOS DE EQUIVALENCIA TERAPÉUTICA DE MEDICAMENTOS MONODROGAS DE LIBERACIÓN MODIFICADA
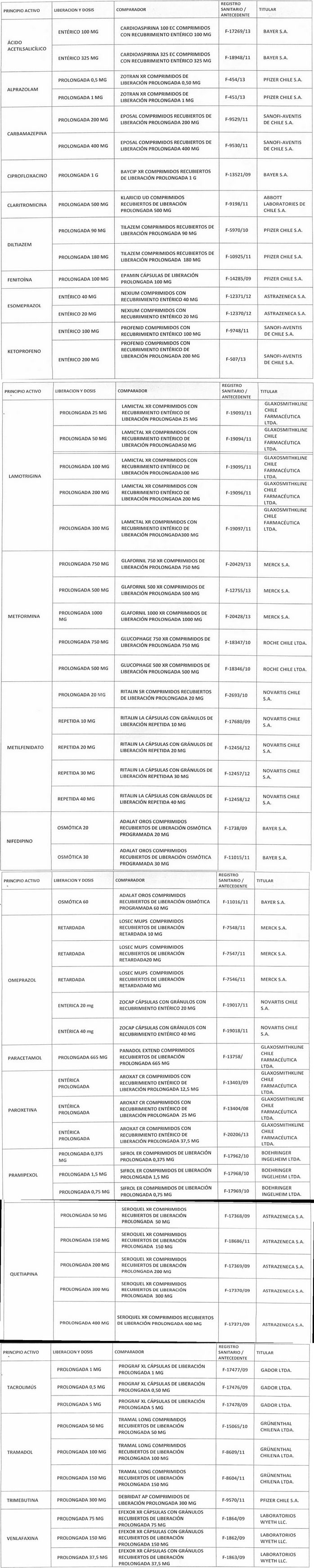
Artículo segundo.- Un texto actualizado de la norma, conteniendo la modificación que se aprueba en este decreto y las anteriores realizadas, se mantendrá en el Departamento de Políticas Farmacéuticas y Profesiones Médicas de la División de Políticas Públicas Saludables y Promoción de la Subsecretaría de Salud Pública, entidad que a su vez deberá velar por su oportuna publicación en la página web del Ministerio de Salud, www.minsal.cl, para su adecuado conocimiento y difusión, debiendo además asegurar que las copias y reproducciones que se emitan guarden estricta concordancia con el texto aprobado.
Artículo tercero: Las disposiciones de este decreto regirán desde su publicación en el Diario Oficial.
Artículo cuarto: Otórguese como plazo, el período entre la publicación de este decreto en el Diario Oficial y el día 31 de diciembre de Decreto 1162, SALUD
Art. SEGUNDO
D.O. 16.12.20152016, para cumplir con la exigencia de presentación de estudios de equivalencia terapéutica en el caso de los productos farmacéuticos ya registrados que contengan, como monodrogas de liberación convencional o modificada, según corresponda, los principios activos señalados en el artículo primero, los que deberán realizarse respecto de los productos referentes establecidos en el mismo artículo.
Art. SEGUNDO
D.O. 16.12.20152016, para cumplir con la exigencia de presentación de estudios de equivalencia terapéutica en el caso de los productos farmacéuticos ya registrados que contengan, como monodrogas de liberación convencional o modificada, según corresponda, los principios activos señalados en el artículo primero, los que deberán realizarse respecto de los productos referentes establecidos en el mismo artículo.
| Tipo Versión | Desde | Hasta | Modificaciones | |
|---|---|---|---|---|
|
Última Versión
De 16-DIC-2015
|
16-DIC-2015 | |||
|
Texto Original
De 13-MAR-2014
|
13-MAR-2014 | 15-DIC-2015 |
Comparando Decreto 123 EXENTO |
Loading...